全文编译!我国香港大学揭示SARS-CoV-2在金黄地鼠中的发病机制和传播
来源:本站原创 2020-05-23 06:22
2020年5月23日讯/生物谷BIOON/---2019年12月,在中国湖北省武汉市的一群肺炎患者中首次检测到SARS-CoV-2。虽然这些初始病例的55%与一个销售野生动物的海鲜批发市场有关,但多种病毒因素(有症状的患者和症状前患者导致人与人之间的持续传播)和生态因素(中国农历新年期间国内外广泛的旅行)促使这种病毒在快速传播。2019年新型冠状病毒病(CO
2020年5月23日讯/生物谷BIOON/---2019年12月,在中国湖北省武汉市的一群肺炎患者中首次检测到SARS-CoV-2。虽然这些初始病例的55%与一个销售野生动物的海鲜批发市场有关,但多种病毒因素(有症状的患者和症状前患者导致人与人之间的持续传播)和生态因素(中国农历新年期间国内外广泛的旅行)促使这种病毒在快速传播。2019年新型冠状病毒病(COVID-19)患者的临床表现很广。在中国72314例有症状患者中,19%的人进展为重症和危重症,估计有1.4%的有症状病例面临死亡风险。目前还没有获批的疫苗或药物来抵抗SARS-CoV-2,而且包括国家封锁和社交距离在内的现有干预措施严重扰乱了全球供应链和经济。
一种合适的动物模型对于了解这种疾病的发病机制以及评估疫苗和治疗性候选药物至关重要。以往针对SARS-CoV的动物研究已表明病毒刺突蛋白(S蛋白)与宿主血管紧张素转换酶2(ACE2)受体之间的相互作用以及动物的年龄和先天免疫状态可能在发病机制中起着重要的作用。与SARS-CoV一样,SARS-CoV-2的S蛋白也利用主要分布在肺部和小肠上皮细胞中的ACE2受体来进入上皮细胞以进行病毒复制。SARS-CoV-2对人ACE2表现出良好的结合,但对小鼠ACE2的结合有限,这就限制了近交系小鼠在研究中的使用。表达人ACE2受体的猕猴和转基因ICR小鼠对SARS-CoV-2感染易感;然而,这些动物模型的可用性有限。食蟹猴和恒河猴在遭受SARS-CoV-2挑战后都分别表现出有限的和中度的肺炎临床症状。遭受SARS-CoV-2挑战的转基因小鼠表现出肺炎、中度消瘦,它们的非呼吸道组织无明显组织学变化。此前有报道称,表达人ACE2受体的转基因小鼠在气道上皮细胞中支持SARS-CoV复制,但由于大脑中ACE2的较高表达,它们会出现与神经系统相关的死亡。
金黄地鼠(Golden Syrian hamster,也称叙利亚地鼠或黄金仓鼠)是一种广泛使用的实验动物模型,有报道称它们支持SARS-CoV复制,但不支持MERS-CoV复制,其中MERS-CoV利用二肽基肽酶-4(DPP4)蛋白作为病毒进入细胞的主要受体。先前对5周龄金黄地鼠进行的SARS-CoV(Urbani毒株)研究显示,这种病毒强劲地复制,在病毒接种两天后在肺部检测到的病毒滴度达到峰值,随后在病毒接种后七天内将这种病毒快速清除,但接种后的金黄地鼠没有体重下降或患病的证据。一项后续研究报告了对金黄地鼠进行不同SARS-CoV毒株的检测,发现不同SARS-CoV毒株之间的毒力存在差异;用Frk-1毒株接种的金黄地鼠出现了致死性,这种毒株与非致死的Urbani毒株的差异在于S蛋白的S2结构域发生了L1148F突变。地鼠容易被其他呼吸道病毒感染,包括人类偏肺病毒、人类副流感病毒3型和甲型流感病毒,并可能通过接触或空气传播途径促进流感传播。人类、猕猴、小鼠和地鼠的ACE2蛋白序列比对表明,SARS-CoV-2的S蛋白与地鼠ACE2的相互作用可能比小鼠ACE2更有效。
在一项新的研究中,来自中国香港大学的研究人员评估了SARS-CoV-2在4~5周龄的雄性金黄地鼠中的发病机制和接触传播性。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Pathogenesis and transmission of SARS-CoV-2 in golden hamsters”。
利用从一名香港确诊的COVID-19患者的鼻咽抽出物和咽喉拭子中分离出的BetaCoV/Hong Kong/VM20001061/2020病毒(GISAID# EPI_ISL_412028)在Vero E6细胞系中进行增殖,然后利用增殖后的8×104 TCID50的病毒经鼻内感染金黄地鼠。在接种病毒后第2、5和7天时,采集它们的鼻甲骨、大脑、肺部、心脏、十二指肠、肝脏、脾脏和肾脏样本,以监测病毒复制和组织病理学变化。肺部的病毒载量在接种病毒后第2天时达到峰值,在接种病毒后第5天时出现下降;尽管在接种病毒后第7天时继续检测到高拷贝的病毒RNA,但没有检测到传染性病毒(图1a)。传染性病毒载量在接种病毒后第2天和第7天之间有显著差异(P=0.019,邓恩多重比较检验),但是RNA拷贝数则没有(P=0.076)。没有在肾脏中检测到传染性病毒,虽然在接种病毒后第2天和第5天时检测到低拷贝的病毒RNA(图1b)。
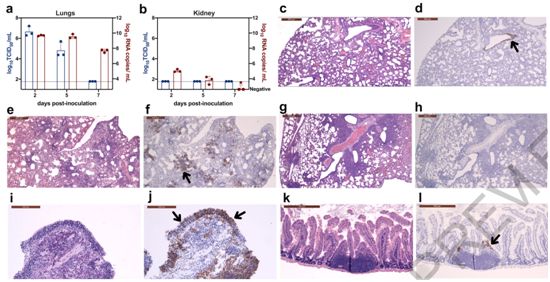
组织病理学检查发现,在接种病毒后第2天时,炎症细胞增加,5~10%的肺部出现实变(Fig. 1c, 1d),在接种病毒后第5天时有15~35%的肺部出现实变(图1e,1f)。在接种病毒后第2天和第5天时检测到病毒抗原的区域观察到单核细胞浸润。针对SARS-CoV-2 N蛋白的免疫组化实验显示,在接种病毒后第2天时(图1d)在支气管上皮细胞中检测到病毒抗原,而在接种病毒后第5天时也在肺细胞中检测到(图1f)。在接种病毒后第7天时,有30~60%的肺部出现实变增加(图1g);然而,没有检测到病毒抗原(图1h),2型肺细胞增生明显。
在接种病毒后第5天时,CD3阳性T淋巴细胞在支气管周围区域检测到,这可能有利于受感染细胞的快速清除。鼻甲骨内有中度的炎症细胞浸润(图1i),在鼻上皮细胞(图1j)和鼻粘膜的嗅觉神经元中检测到病毒抗原(图1j)。
嗅觉神经元中的感染进一步在表达SARS-CoV N蛋白和神经元特异性β-III微管蛋白的细胞中证实了。在接种病毒后第2天时,与作为对照的模拟感染(mock infection)相比,病毒感染导致鼻粘膜中的嗅觉神经元的数量减少,在接种病毒后第7天时鼻上皮明显衰减,在接种病毒后第14天时相关组织损伤受到修复。虽然没有炎症存在(图1k),但是在接种病毒后第2天时,从十二指肠上皮细胞上皮细胞中检测到病毒抗原(图1l)。这类似于在SARS-CoV感染者的末端回肠和结肠的上皮细胞中检测到SARS-CoV病毒复制,没有观察到明显的结构破坏和炎症浸润。在接种病毒后第5天时,在大脑、心脏、肝脏和肾脏中没有观察到明显的组织病理变化。
为了评估SARS-CoV-2在地鼠中的传播潜力,3只供体地鼠鼻内接种8×104 TCID50的病毒。在接种病毒后24小时时,每只供体地鼠被转移到一个新的笼子里,并与一只未接触过这种病毒的地鼠共同居住在一起。每天监测体重变化和临床体征,每隔一天从供体地鼠和接触地鼠中收集鼻腔冲洗液,持续14天。在供体地鼠中,在接种后的早期,鼻腔冲洗液中的传染性病毒载量达到了峰值,随后迅速下降,尽管在14天内连续检测到了病毒RNA(图2a)。
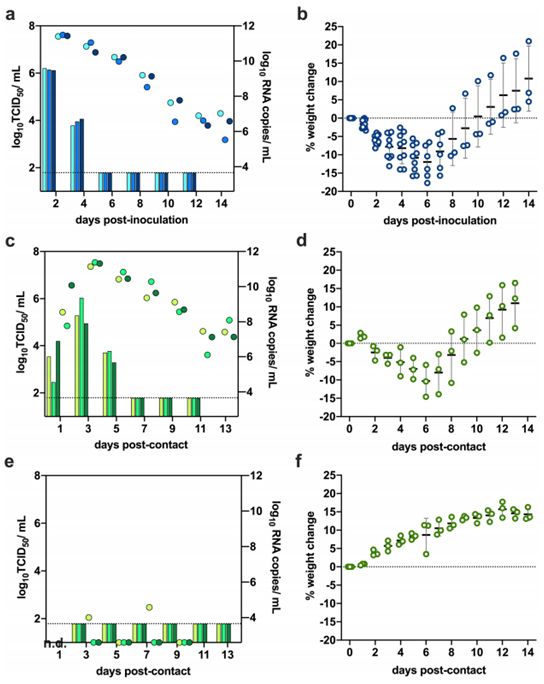
接种SARS-CoV-2的地鼠在接种后第6天时表现出最大的平均体重下降(平均±SD,-11.97±4.51%,N=6)(图2b)。从供体地鼠到共同居住在一起的接触地鼠的传播是有效的,SARS-CoV-2在接触后第1天就从接触地鼠中检测到SARS-CoV-2,在接触后第3天时鼻腔冲洗液中检测到的病毒载量达到峰值(图2c)。通过计算每只地鼠的曲线下面积(AUC)来近似计算鼻腔冲洗液中的总病毒载量。与供体地鼠相比,接触地鼠在鼻腔冲洗液中脱落的病毒载量相当(P=0.1,双尾曼-惠特尼检验)。接触地鼠在接触后第6天时表现出最大的平均体重下降(平均±SD,-10.68±3.42%,N=3);所有地鼠在接触后第11天时恢复到原来的体重(图2d)。利用蚀斑减少中和试验(PRNT)检测中和抗体,在接种病毒后第14天时从供体地鼠中检测到的中和抗体滴度均为1:640和在接触后第13天时从3只接触地鼠中检测到的中和抗体滴度分别为1:160、1:320和1:160。
鉴于连续14天在供体地鼠的鼻腔冲洗液中检测到病毒RNA,但传染性病毒滴度迅速下降,香港大学的研究人员重复了这一实验,在接种病毒后第6天时让之前没有接触这种病毒的地鼠与供体地鼠共同居住在一起。在接触后第3天和第7天时在一只接触地鼠的鼻腔冲洗液中检测到低量的病毒RNA,但没有在鼻腔冲洗液中检测到传染性病毒(图2e),而且没有一只接触地鼠表现出体重下降(图2f)。PRNT试验在在接触后第12天时没有从接触地鼠中检测中和抗体(<1:10)。这些结果表明,接种了SARS-CoV-2的供体地鼠的SARS-CoV-2传染期短于6天。从供体地鼠到共同居住在一起的接触地鼠的继续传播能力与供体地鼠鼻腔冲洗液中检测到的传染性病毒有关,但与那里检测到的病毒RNA无关。
从供体地鼠到共同居住在一起的接触地鼠的传播可能通过多种传播途径进行。为了研究SARS-CoV-2在地鼠之间通过气溶胶的传播能力,在接种病毒后第1天,将供体地鼠和之前没有接触这种病毒但可与供体地鼠进行气溶胶接触的地鼠(下称气溶胶接触地鼠)放置在两个相邻的铁丝笼子里8小时。该实验在三对供体地鼠-气溶胶接触地鼠(以1:1的比例)中进行。在暴露于病毒后,将地鼠在单个笼子中饲养,每天对它们进行监测,连续监测14天。供体地鼠在鼻腔冲洗液中脱落传染性病毒6天,而且连续14天可检测病毒RNA(图3a)。在接种病毒后第2、4和6天时,在供体地鼠的粪便样本中检测到病毒RNA,但没有检测到传染性病毒( 图3b)。正如之前观察到的那样(图2b),供体地鼠表现出类似的体重减少(图3c)。
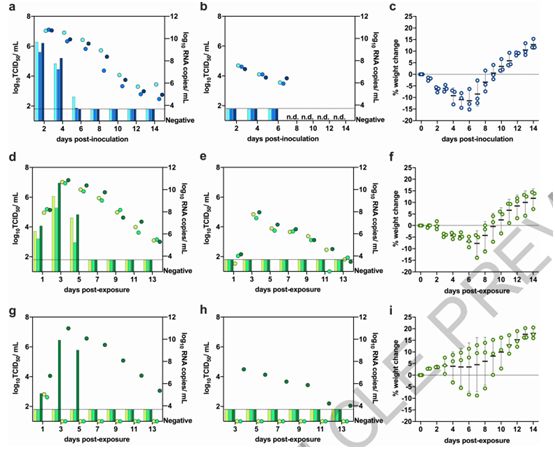
通过气溶胶的病毒传播是有效的,这是因为在接触后第1天时就从所有暴露于病毒的气溶胶接触地鼠的鼻腔冲洗液中检测到传染性病毒,在接触后第3天时检测到的病毒载量达到峰值(图3d)。从受感染的气溶胶接触地鼠的粪便样本中连续14天检测到病毒RNA,虽然从中没有分离出传染性病毒(图3e)。气溶胶接触地鼠在接触后第7天时表现出最大的体重下降(平均±SD,-7.72±5,42%,N=3)(图3f)。
与供体地鼠相比,气溶胶接触地鼠在鼻腔冲洗液中脱落的病毒载量相当(P=0.4,双尾曼-惠特尼检验)。PRNT试验在病毒接种后第16天时在供体仓鼠中检测到中和抗体(病毒滴度分别为1:320、1:640、1:640、1:640),在接触后第15天时,从气溶胶接触地鼠中检测到中和抗体(三只气溶胶接触地鼠的抗体滴度均为1:640)。
为了评估SARS-CoV-2通过污染物(fomite)的传播潜力,将3只未接触污染物的地鼠中的每只分别被放置到不同的在病毒接种后第0~2天之前住过供体地鼠而被弄脏的笼子中。将污染物接触地鼠单独饲养在被弄脏的笼子里48小时,并在接触后第2天时分别转移到一个新的笼子里(相当于供体地鼠的病毒接种后第4天)。从用于污染物接触地鼠居住的被弄脏笼子的不同表面采样以便检测病毒RNA,从笼子内垫材(病毒接种后第2天)、笼子侧表面(病毒接种后第4天)和水瓶喷嘴(病毒接种后第4天)的表面上检测到了低滴度的传染性病毒。在3只污染物接触地鼠中,有一只从接触后第1天开始就在鼻腔冲洗液中检测到传染性病毒,在接触后第3天时,检测到的病毒载量达到峰值(图3g)。从粪便样本中检测到病毒RNA,但没有检测到传染性病毒(图3h)。在接触后第7天时的最大减重率为8.79%(图3i)。在接触后第16天时,PRNT试验从3只污染物接触地鼠的血清中检测到中和抗体(滴度为1:320)。综上所述,这些结果表明,SARS-CoV-2在地鼠中的传播主要是通过气溶胶而不是通过污染物来介导的。
这些研究结果表明,金黄地鼠是SARS-CoV-2的合适实验动物模型,这种因为病毒接种的地鼠和自然感染的地鼠有明显的体重下降,并且有证据表明这种病毒在鼻粘膜和下呼吸道上皮细胞中可有效复制。SARS-CoV-2感染鼻粘膜嗅觉神经元的能力可能解释了在COVID-19患者中报告的嗅觉缺失。地鼠支持通过直接接触或通过气溶胶将SARS-CoV-2从病毒接种的供体地鼠向之前未接触过这种病毒的地鼠有效传播。
这些研究人员还发现,从供体地鼠到之前未接触过这种病毒的地鼠的传播可能在接种后早期的短时间内发生。这些研究结果与最近的一份报告一致,尽管这项新的研究还在同行评审中。地鼠很容易处理,并且存在用于支持疫苗开发的免疫学研究的试剂。
这些研究结果还强调了SARS-CoV和SARS-CoV-2在地鼠模型中的相似性和差异。这两种病毒均在呼吸道上皮细胞中高效复制,接种后早期检测到病毒载量达到峰值,随后单核炎症细胞在肺部中浸润,在病毒接种后7天内迅速清除传染性病毒。了解导致地鼠呼吸道组织中病毒快速清除的宿主防御机制,可能有助于制定有效的SARS-CoV-2防治措施。SARS-CoV-2通过气溶胶有效地传播给之前未接触过这种病毒的地鼠,也为了解这种新型冠状病毒的传播动态提供了机会。(生物谷 Bioon.com)
参考资料:
Sin Fun Sia et al. Pathogenesis and transmission of SARS-CoV-2 in golden hamsters. Nature, 2020, doi:10.1038/s41586-020-2342-5.
一种合适的动物模型对于了解这种疾病的发病机制以及评估疫苗和治疗性候选药物至关重要。以往针对SARS-CoV的动物研究已表明病毒刺突蛋白(S蛋白)与宿主血管紧张素转换酶2(ACE2)受体之间的相互作用以及动物的年龄和先天免疫状态可能在发病机制中起着重要的作用。与SARS-CoV一样,SARS-CoV-2的S蛋白也利用主要分布在肺部和小肠上皮细胞中的ACE2受体来进入上皮细胞以进行病毒复制。SARS-CoV-2对人ACE2表现出良好的结合,但对小鼠ACE2的结合有限,这就限制了近交系小鼠在研究中的使用。表达人ACE2受体的猕猴和转基因ICR小鼠对SARS-CoV-2感染易感;然而,这些动物模型的可用性有限。食蟹猴和恒河猴在遭受SARS-CoV-2挑战后都分别表现出有限的和中度的肺炎临床症状。遭受SARS-CoV-2挑战的转基因小鼠表现出肺炎、中度消瘦,它们的非呼吸道组织无明显组织学变化。此前有报道称,表达人ACE2受体的转基因小鼠在气道上皮细胞中支持SARS-CoV复制,但由于大脑中ACE2的较高表达,它们会出现与神经系统相关的死亡。
金黄地鼠(Golden Syrian hamster,也称叙利亚地鼠或黄金仓鼠)是一种广泛使用的实验动物模型,有报道称它们支持SARS-CoV复制,但不支持MERS-CoV复制,其中MERS-CoV利用二肽基肽酶-4(DPP4)蛋白作为病毒进入细胞的主要受体。先前对5周龄金黄地鼠进行的SARS-CoV(Urbani毒株)研究显示,这种病毒强劲地复制,在病毒接种两天后在肺部检测到的病毒滴度达到峰值,随后在病毒接种后七天内将这种病毒快速清除,但接种后的金黄地鼠没有体重下降或患病的证据。一项后续研究报告了对金黄地鼠进行不同SARS-CoV毒株的检测,发现不同SARS-CoV毒株之间的毒力存在差异;用Frk-1毒株接种的金黄地鼠出现了致死性,这种毒株与非致死的Urbani毒株的差异在于S蛋白的S2结构域发生了L1148F突变。地鼠容易被其他呼吸道病毒感染,包括人类偏肺病毒、人类副流感病毒3型和甲型流感病毒,并可能通过接触或空气传播途径促进流感传播。人类、猕猴、小鼠和地鼠的ACE2蛋白序列比对表明,SARS-CoV-2的S蛋白与地鼠ACE2的相互作用可能比小鼠ACE2更有效。
在一项新的研究中,来自中国香港大学的研究人员评估了SARS-CoV-2在4~5周龄的雄性金黄地鼠中的发病机制和接触传播性。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Pathogenesis and transmission of SARS-CoV-2 in golden hamsters”。
利用从一名香港确诊的COVID-19患者的鼻咽抽出物和咽喉拭子中分离出的BetaCoV/Hong Kong/VM20001061/2020病毒(GISAID# EPI_ISL_412028)在Vero E6细胞系中进行增殖,然后利用增殖后的8×104 TCID50的病毒经鼻内感染金黄地鼠。在接种病毒后第2、5和7天时,采集它们的鼻甲骨、大脑、肺部、心脏、十二指肠、肝脏、脾脏和肾脏样本,以监测病毒复制和组织病理学变化。肺部的病毒载量在接种病毒后第2天时达到峰值,在接种病毒后第5天时出现下降;尽管在接种病毒后第7天时继续检测到高拷贝的病毒RNA,但没有检测到传染性病毒(图1a)。传染性病毒载量在接种病毒后第2天和第7天之间有显著差异(P=0.019,邓恩多重比较检验),但是RNA拷贝数则没有(P=0.076)。没有在肾脏中检测到传染性病毒,虽然在接种病毒后第2天和第5天时检测到低拷贝的病毒RNA(图1b)。

图1.金黄色地鼠鼻内感染SARS-CoV-2后的病毒载量和组织病理学变化。
组织病理学检查发现,在接种病毒后第2天时,炎症细胞增加,5~10%的肺部出现实变(Fig. 1c, 1d),在接种病毒后第5天时有15~35%的肺部出现实变(图1e,1f)。在接种病毒后第2天和第5天时检测到病毒抗原的区域观察到单核细胞浸润。针对SARS-CoV-2 N蛋白的免疫组化实验显示,在接种病毒后第2天时(图1d)在支气管上皮细胞中检测到病毒抗原,而在接种病毒后第5天时也在肺细胞中检测到(图1f)。在接种病毒后第7天时,有30~60%的肺部出现实变增加(图1g);然而,没有检测到病毒抗原(图1h),2型肺细胞增生明显。
在接种病毒后第5天时,CD3阳性T淋巴细胞在支气管周围区域检测到,这可能有利于受感染细胞的快速清除。鼻甲骨内有中度的炎症细胞浸润(图1i),在鼻上皮细胞(图1j)和鼻粘膜的嗅觉神经元中检测到病毒抗原(图1j)。
嗅觉神经元中的感染进一步在表达SARS-CoV N蛋白和神经元特异性β-III微管蛋白的细胞中证实了。在接种病毒后第2天时,与作为对照的模拟感染(mock infection)相比,病毒感染导致鼻粘膜中的嗅觉神经元的数量减少,在接种病毒后第7天时鼻上皮明显衰减,在接种病毒后第14天时相关组织损伤受到修复。虽然没有炎症存在(图1k),但是在接种病毒后第2天时,从十二指肠上皮细胞上皮细胞中检测到病毒抗原(图1l)。这类似于在SARS-CoV感染者的末端回肠和结肠的上皮细胞中检测到SARS-CoV病毒复制,没有观察到明显的结构破坏和炎症浸润。在接种病毒后第5天时,在大脑、心脏、肝脏和肾脏中没有观察到明显的组织病理变化。
为了评估SARS-CoV-2在地鼠中的传播潜力,3只供体地鼠鼻内接种8×104 TCID50的病毒。在接种病毒后24小时时,每只供体地鼠被转移到一个新的笼子里,并与一只未接触过这种病毒的地鼠共同居住在一起。每天监测体重变化和临床体征,每隔一天从供体地鼠和接触地鼠中收集鼻腔冲洗液,持续14天。在供体地鼠中,在接种后的早期,鼻腔冲洗液中的传染性病毒载量达到了峰值,随后迅速下降,尽管在14天内连续检测到了病毒RNA(图2a)。

图2.金色地鼠通过直接接触传播SARS-CoV-2。
接种SARS-CoV-2的地鼠在接种后第6天时表现出最大的平均体重下降(平均±SD,-11.97±4.51%,N=6)(图2b)。从供体地鼠到共同居住在一起的接触地鼠的传播是有效的,SARS-CoV-2在接触后第1天就从接触地鼠中检测到SARS-CoV-2,在接触后第3天时鼻腔冲洗液中检测到的病毒载量达到峰值(图2c)。通过计算每只地鼠的曲线下面积(AUC)来近似计算鼻腔冲洗液中的总病毒载量。与供体地鼠相比,接触地鼠在鼻腔冲洗液中脱落的病毒载量相当(P=0.1,双尾曼-惠特尼检验)。接触地鼠在接触后第6天时表现出最大的平均体重下降(平均±SD,-10.68±3.42%,N=3);所有地鼠在接触后第11天时恢复到原来的体重(图2d)。利用蚀斑减少中和试验(PRNT)检测中和抗体,在接种病毒后第14天时从供体地鼠中检测到的中和抗体滴度均为1:640和在接触后第13天时从3只接触地鼠中检测到的中和抗体滴度分别为1:160、1:320和1:160。
鉴于连续14天在供体地鼠的鼻腔冲洗液中检测到病毒RNA,但传染性病毒滴度迅速下降,香港大学的研究人员重复了这一实验,在接种病毒后第6天时让之前没有接触这种病毒的地鼠与供体地鼠共同居住在一起。在接触后第3天和第7天时在一只接触地鼠的鼻腔冲洗液中检测到低量的病毒RNA,但没有在鼻腔冲洗液中检测到传染性病毒(图2e),而且没有一只接触地鼠表现出体重下降(图2f)。PRNT试验在在接触后第12天时没有从接触地鼠中检测中和抗体(<1:10)。这些结果表明,接种了SARS-CoV-2的供体地鼠的SARS-CoV-2传染期短于6天。从供体地鼠到共同居住在一起的接触地鼠的继续传播能力与供体地鼠鼻腔冲洗液中检测到的传染性病毒有关,但与那里检测到的病毒RNA无关。
从供体地鼠到共同居住在一起的接触地鼠的传播可能通过多种传播途径进行。为了研究SARS-CoV-2在地鼠之间通过气溶胶的传播能力,在接种病毒后第1天,将供体地鼠和之前没有接触这种病毒但可与供体地鼠进行气溶胶接触的地鼠(下称气溶胶接触地鼠)放置在两个相邻的铁丝笼子里8小时。该实验在三对供体地鼠-气溶胶接触地鼠(以1:1的比例)中进行。在暴露于病毒后,将地鼠在单个笼子中饲养,每天对它们进行监测,连续监测14天。供体地鼠在鼻腔冲洗液中脱落传染性病毒6天,而且连续14天可检测病毒RNA(图3a)。在接种病毒后第2、4和6天时,在供体地鼠的粪便样本中检测到病毒RNA,但没有检测到传染性病毒( 图3b)。正如之前观察到的那样(图2b),供体地鼠表现出类似的体重减少(图3c)。

图3.金色地鼠通过气溶胶和污染物传播SARS-CoV-2。
通过气溶胶的病毒传播是有效的,这是因为在接触后第1天时就从所有暴露于病毒的气溶胶接触地鼠的鼻腔冲洗液中检测到传染性病毒,在接触后第3天时检测到的病毒载量达到峰值(图3d)。从受感染的气溶胶接触地鼠的粪便样本中连续14天检测到病毒RNA,虽然从中没有分离出传染性病毒(图3e)。气溶胶接触地鼠在接触后第7天时表现出最大的体重下降(平均±SD,-7.72±5,42%,N=3)(图3f)。
与供体地鼠相比,气溶胶接触地鼠在鼻腔冲洗液中脱落的病毒载量相当(P=0.4,双尾曼-惠特尼检验)。PRNT试验在病毒接种后第16天时在供体仓鼠中检测到中和抗体(病毒滴度分别为1:320、1:640、1:640、1:640),在接触后第15天时,从气溶胶接触地鼠中检测到中和抗体(三只气溶胶接触地鼠的抗体滴度均为1:640)。
为了评估SARS-CoV-2通过污染物(fomite)的传播潜力,将3只未接触污染物的地鼠中的每只分别被放置到不同的在病毒接种后第0~2天之前住过供体地鼠而被弄脏的笼子中。将污染物接触地鼠单独饲养在被弄脏的笼子里48小时,并在接触后第2天时分别转移到一个新的笼子里(相当于供体地鼠的病毒接种后第4天)。从用于污染物接触地鼠居住的被弄脏笼子的不同表面采样以便检测病毒RNA,从笼子内垫材(病毒接种后第2天)、笼子侧表面(病毒接种后第4天)和水瓶喷嘴(病毒接种后第4天)的表面上检测到了低滴度的传染性病毒。在3只污染物接触地鼠中,有一只从接触后第1天开始就在鼻腔冲洗液中检测到传染性病毒,在接触后第3天时,检测到的病毒载量达到峰值(图3g)。从粪便样本中检测到病毒RNA,但没有检测到传染性病毒(图3h)。在接触后第7天时的最大减重率为8.79%(图3i)。在接触后第16天时,PRNT试验从3只污染物接触地鼠的血清中检测到中和抗体(滴度为1:320)。综上所述,这些结果表明,SARS-CoV-2在地鼠中的传播主要是通过气溶胶而不是通过污染物来介导的。
这些研究结果表明,金黄地鼠是SARS-CoV-2的合适实验动物模型,这种因为病毒接种的地鼠和自然感染的地鼠有明显的体重下降,并且有证据表明这种病毒在鼻粘膜和下呼吸道上皮细胞中可有效复制。SARS-CoV-2感染鼻粘膜嗅觉神经元的能力可能解释了在COVID-19患者中报告的嗅觉缺失。地鼠支持通过直接接触或通过气溶胶将SARS-CoV-2从病毒接种的供体地鼠向之前未接触过这种病毒的地鼠有效传播。
这些研究人员还发现,从供体地鼠到之前未接触过这种病毒的地鼠的传播可能在接种后早期的短时间内发生。这些研究结果与最近的一份报告一致,尽管这项新的研究还在同行评审中。地鼠很容易处理,并且存在用于支持疫苗开发的免疫学研究的试剂。
这些研究结果还强调了SARS-CoV和SARS-CoV-2在地鼠模型中的相似性和差异。这两种病毒均在呼吸道上皮细胞中高效复制,接种后早期检测到病毒载量达到峰值,随后单核炎症细胞在肺部中浸润,在病毒接种后7天内迅速清除传染性病毒。了解导致地鼠呼吸道组织中病毒快速清除的宿主防御机制,可能有助于制定有效的SARS-CoV-2防治措施。SARS-CoV-2通过气溶胶有效地传播给之前未接触过这种病毒的地鼠,也为了解这种新型冠状病毒的传播动态提供了机会。(生物谷 Bioon.com)
参考资料:
Sin Fun Sia et al. Pathogenesis and transmission of SARS-CoV-2 in golden hamsters. Nature, 2020, doi:10.1038/s41586-020-2342-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


