研究揭示琥珀酸受体配体识别和激活的结构基础
来源:网络 2024-06-12 12:48
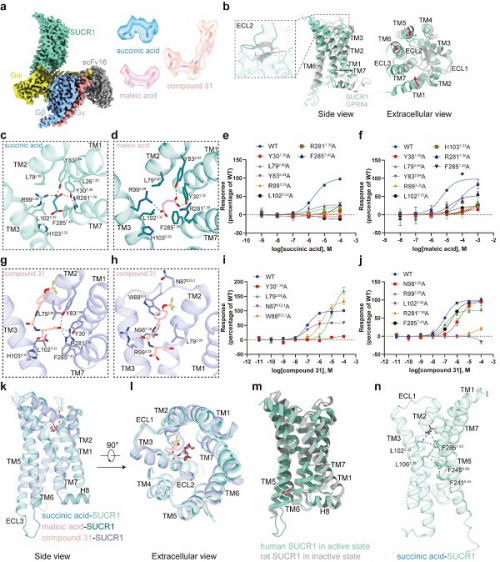
该研究利用单颗粒冷冻电镜技术,分别解析SUCR1被琥珀酸、马来酸和compound 31激活,并偶联下游G蛋白复合物的结构,分辨率分别为2.75埃、2.69埃和2.48埃。
中国科学院上海药物研究所徐华强团队联合复旦大学付伟团队,在《细胞研究》(Cell Research)上发表了题为Molecular basis of ligand recognition and activation of the human succinate receptor SUCR1的最新研究成果。该工作报道了人源SUCR1独特的配体结合特征和激活机制,为开发新型靶向SUCR1的化合物奠定了基础。
既往研究发现,琥珀酸是三羧酸循环重要的中间产物,在调控线粒体氧化应激的稳态中发挥重要作用,而这一功能主要通过G蛋白偶联受体家族中的重要成员SUCR1介导。SUCR1亦被称为GPR91。有研究证实琥珀酸是SUCR1的内源性配体。后续研究发现,该受体的激活与肝纤维化、高血压和类风湿性关节炎等相关。因此,研究SUCR1的配体识别机制和激活机制,对于探讨SUCR1的生理功能并开发靶向SUCR1的药物具有积极意义。
该研究利用单颗粒冷冻电镜技术,分别解析SUCR1被琥珀酸、马来酸和compound 31激活,并偶联下游G蛋白复合物的结构,分辨率分别为2.75埃、2.69埃和2.48埃。结构分析发现,在琥珀酸和SUCR1的复合物结构中,琥珀酸两端亲水性的羧基与Y301.39、Y832.64形成氢键,与R993.29、R2817.39形成离子键,而中间烷基的部分和周围氨基酸形成疏水相互作用。研究显示,将结合口袋中关键的残基如Y301.39、L792.60、Y832.64、R993.29、R2817.39、L1023.32等突变成丙氨酸均降低了配体的活性,证实了它们在琥珀酸结合和受体活化中的重要作用。马来酸和琥珀酸结构相似,在SUCR1的结合口袋也相似。compound 31是人工合成的高效SUCR1激动剂。在compound 31和SUCR1的复合物结构中,研究发现了两个结合口袋。compound 31的“琥珀酸”部分和琥珀酸、马来酸的结合口袋几乎一致,而“双环”部分使R993.29的侧链发生偏转,进而延伸到一个新的口袋中。这种独特的结合模式可能是compound 31与琥珀酸、马来酸相比更能有效激活SUCR1的原因。关键氨基酸残基的功能突变如Y301.39A、L792.60A、N983.29A等,能够减弱配体的激活效应,揭示了这些相互作用对于配体识别的重要意义。
三种复合物的整体构象较为相似,均捕捉到SUCR1的激活构象——胞内端TM6外移而TM7内移,形成与Gi蛋白C末端α5螺旋交互的空腔,体现了SUCR1与Gi蛋白偶联的经典GPCR活化模式。活化过程中,配体和疏水残基L1023.32、F2857.43形成疏水相互作用,推动F2857.43下移并与L1063.36、F2456.48等残基紧密作用,引发TM6的整体外移,从而完成SUCR1受体活化过程。这阐释了SUCR1的活化机制,揭示了SUCR1与不同配体分子结合的微观细节,为开发新型靶向SUCR1的化合物奠定了基础。
上海药物所为第一完成单位。研究工作得到国家重大科技专项、国家重点基础研究发展计划、国家自然科学基金、上海市市级科技重大专项等的支持。该研究使用的冷冻电镜数据由上海药物所高峰电镜中心收集。
上海药物所等揭示琥珀酸受体配体识别和激活的结构基础
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


