Nature Structural & Molecular Biology:阿尔茨海默症发病机制研究获进展
来源:网络 2022-04-05 11:51
研究发现,脑内蓝斑部位的去甲肾上腺素代谢产物DOPEGAL共价修饰Tau蛋白的K353位点,促进Tau的聚集和病变的播散。
Nature Structural & Molecular Biology在线发表了中国科学院深圳理工大学(筹)叶克强团队和武汉大学人民医院张振涛团队完成的最新成果。研究发现,脑内蓝斑部位的去甲肾上腺素代谢产物DOPEGAL共价修饰Tau蛋白的K353位点,促进Tau的聚集和病变的播散。该研究为探索阿尔茨海默病(Alzheimer’s disease,AD)的发病机制研究提供了新视角。
AD是神经退行性疾病,脑内Tau蛋白的异常聚集是AD重要的病理表现。迄今为止,Tau蛋白异常聚集的分子机制尚不明确。病理学研究发现,蓝斑是脑内Tau蛋白聚集的起始位点之一,Tau蛋白首先在蓝斑形成病理性聚集体,并向其他脑区播散,致使脑内广泛的Tau蛋白聚集和神经损伤,最终导致认知功能障碍的发生。那么,为何蓝斑部位的Tau蛋白更易聚集?
科研团队针对脑内Tau蛋白聚集的分子机制进行了长期探索。前期研究发现,蓝斑部位的单胺氧化酶A(MAO-A)将去甲肾上腺素氧化为DOPAGEL,DOPAGEL激活了天冬酰胺内肽酶(AEP)的表达,AEP剪切Tau蛋白,促进其聚集和播散(Journal of Clinical Investigation,2020)。而后,该团队发现ApoE3与Tau相结合,减少AEP对Tau的剪切,但AD相关的等位基因ApoE4失去了结合Tau蛋白的能力,使Tau更易被AEP剪切;ApoE4能够抑制囊泡单胺转运蛋白VMAT的水平,使去甲肾上腺素难以进入突触囊泡,而滞留在胞浆中被MAO-A氧化,生成DOPAGEL(Acta Neuropathologica,2021)。
最新研究进一步探索了DOPAGEL对Tau的修饰作用,发现DOPAGEL可以直接共价修饰Tau的K353位点,与全长的Tau相比,AEP剪切形成的Tau蛋白片段更易被DOPAGEL修饰。DOPAGEL修饰的Tau蛋白聚集能力更强,且形成的病理性聚集体作为“种子”诱导Tau蛋白单体的聚集能力更强。在Tau转基因小鼠脑内阻断MAO-A的活性,或将Tau的K353位点突变后可以阻断DOPAGEL对Tau的修饰,部分缓解Tau病变的播散。
本研究揭示了为何AD发病过程中蓝斑区域的Tau蛋白首先发生聚集形成病理性包涵体,这对阐释AD患者脑内Tau蛋白聚集体的起始和播散过程具有重要的启示作用。这样,在AD疾病的早期对MAO-A用小分子药物进行抑制或极大减缓Tau的病理改变。然而,这一新机制可否推广到其他与Tau病理改变有关的Tauopathies疾病,需要进一步实验验证。
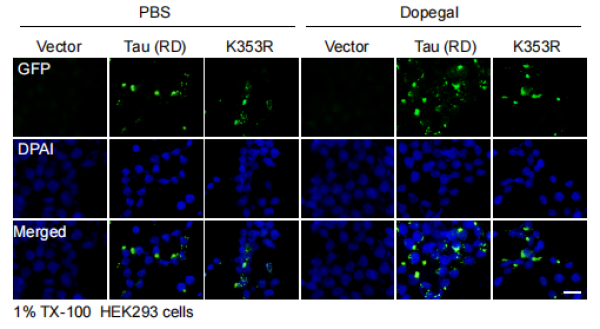
图1.DOPAGEL促进细胞内Tau的聚集而K353R突变可以阻断DOPEGAL的促进作用
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


