《癌细胞》:CAR-T革命!多抗原靶向CAR系统诞生!
来源:奇点糕 2022-11-09 18:23
嵌合抗原受体T(CAR-T)细胞作为一种新兴治疗手段,被称为“活的药物”,掀起了抗肿瘤治疗的革命性变化。
嵌合抗原受体T(CAR-T)细胞作为一种新兴治疗手段,被称为“活的药物”,掀起了抗肿瘤治疗的革命性变化。
与小分子药物不同,CAR-T细胞输注后作用更多样,但是作为“药物”其代谢动力学异质性大、难以直接量化与控制。
以往的研究主要集中于如何提高CAR-T细胞的杀伤能力,增强治疗效果,而随着研究的不断深入以及临床应用的逐步开展,CAR-T细胞疗法的不良反应也越来越引起大家的关注,如细胞因子释放综合征(CRS)、抗原逃逸、T细胞耗竭等,目前应对这些不良反应的方法主要是通过全身免疫抑制、抗体阻断炎性细胞因子或者清除输注的CAR-T细胞等。
这些策略一定程度上可以减轻副作用,但是也会对疗效产生一定的影响,甚至可能引起患者肿瘤复发。而若想再次给予CAR-T治疗,无论是细胞的获得难度、治疗的风险,还是高昂的费用都让人“望而却步”,因此科学家们争相开展相关研究,以期实现通过“第三方”定量且可逆地调节体内CAR-T细胞活性,为其临床应用的进一步开展保驾护航。
2012年到2022年间,已经有多篇文章报道了通过小分子或蛋白调节CAR-T细胞活性的方法。有的研究利用生物素化单链抗体(ScFv),使其作为亲和素化CAR-T细胞(胞外段ScFv被亲和素取代)与肿瘤细胞的“中间人”,实现可控的T细胞激活以及不同抗原靶向性的转换[1]。有的研究则用雷帕霉素类似物作为调节剂[2]。
多种方法各有千秋,但也存在一定的局限性,如一些现有方法使用的小分子或蛋白质,其药代动力学或组织浸润性较差,另外没有获批临床,其安全性尚待验证。
近期,由波士顿大学Wilson W. Wong领衔的研究团队,提出了一系列由口服抗肝炎病毒药物调控的多功能蛋白酶调节CAR(VIPER CAR)系统[3]。
这个系统使用已获美国食品药品监督管理局(FDA)批准的药物,以剂量依赖的方式,可逆地调节CAR-T细胞的活性,显著提高了CAR-T细胞的安全性。在这个系统的基础上,Wong团队设计了多靶向性VIPER CAR,拓宽了CAR-T细胞应用范围。相关文章发表在著名期刊Cancer Cell上。

论文首页截图
具体来说,他们在CAR-T细胞中引入丙肝病毒非结构蛋白3(NS3)蛋白酶,利用抑制NS3蛋白酶活性的药物,通过多种不同结构设计的VIPER CAR系统,实现对CAR-T细胞活性“ON”和“OFF”的可逆调节。
NS3是丙型肝炎病毒生命周期中的一个关键蛋白,它能在自身下游非结构蛋白的连接位点上以蛋白质水解的方式裂解病毒多蛋白,而这种水解活性可以被多种药物抑制,目前已经有多种抑制NS3蛋白水解活性的药物(如格佐匹韦/Grazoprevir,GZV等)被FDA批准用于成人丙型肝炎的治疗。
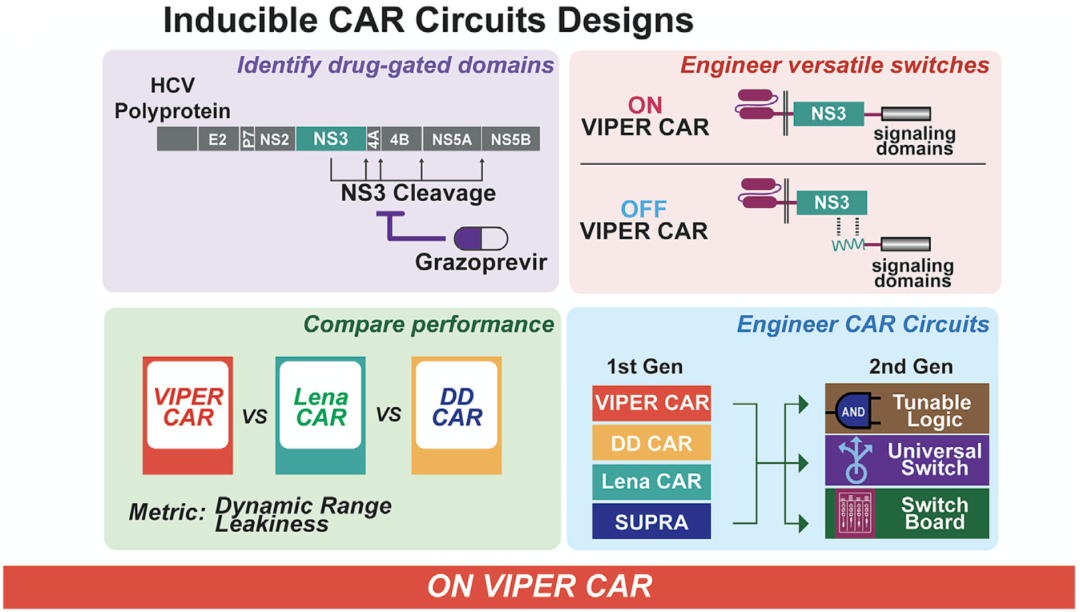
VIPER CAR系统作用机制
实际上,NS3与CAR-T细胞的联合已经不是第一次被提出,周剑锋、Wenshe Ray Liu团队[4]和Jennifer R. Cochran、Crystal L. Mackall团队[5]分别在Angewandte Chemie和Cell杂志先后发表了不同设计的NS3蛋白酶控CAR系统。
与以往报道不同,Wong团队设计并验证了基础的“ON”或“OFF” VIPER CAR系统的功能与药物可控性,并在CRS动物模型上验证了该系统对传统CAR-T治疗CRS不良反应的有效控制。
此外,他们进一步提出了更复杂的、具有多路控制功能的二代VIPER CAR系统,以应对复杂多变的肿瘤细胞。
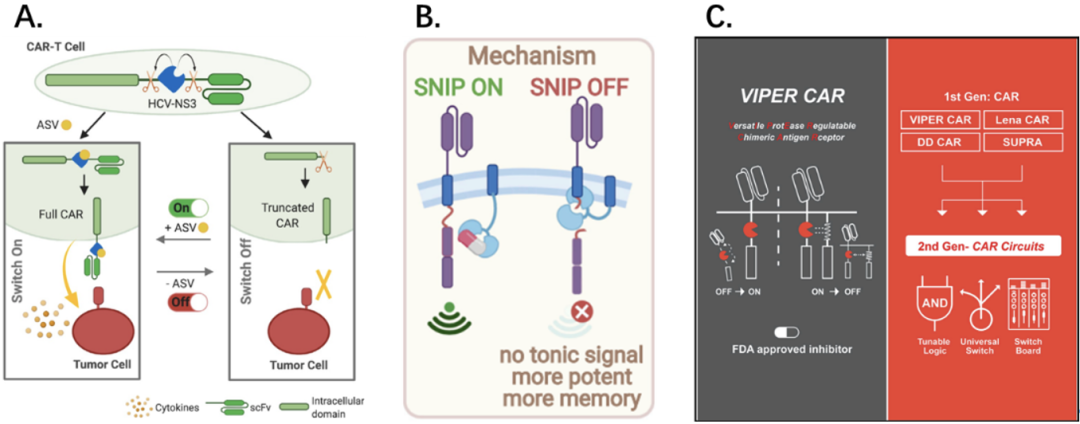
已发表文献中不同设计的NS3蛋白酶控CAR系统示意图
下图展示了“ON”和“OFF” VIPER CAR基础设计。ON系统(A)是单链系统。在不添加药物的情况下,NS3发挥酶切作用,CAR不能形成完整的信号转导;而有药物时,NS3水解作用被抑制,形成完整的CAR,发挥抗肿瘤作用(即添加药物时,系统处于“ON”的状态)。
OFF系统(B)是两个分离元件,将胞外抗原识别结构域与胞内CD3ζ结构域分别置于两个分离的元件,通过NS3和NS3结合肽连接。在不添加药物的情况下,NS3与靶向肽结合,连接两个分离元件,形成完整的CAR信号转导;有药物时,NS3被竞争性结合,CAR不完整,T细胞不能被激活(即添加药物时,系统处于“OFF”的状态)。

“ON”和“OFF” VIPER CAR机制示意图
体外实验显示VIPER CAR-T细胞系统具有肿瘤细胞杀伤能力,且其杀伤作用与药物剂量具有相关性。
而且移除药物后再次添加药物仍能恢复其功能,由此建立了由药物控制的可逆的VIPER CAR系统(下图为“ON”系统,“OFF”系统得到相似结论)。小鼠体内实验进一步验证了上述结论。
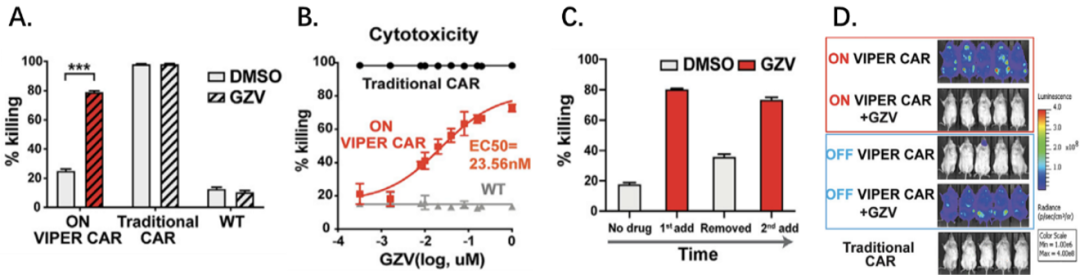
“ON” VIPER CAR系统药物可控性与功能验证
而对于大家非常关心的CAR-T安全性问题,他们利用CRS特异性小鼠模型验证了“OFF” VIPER CAR系统,对传统CAR-T治疗不良反应CRS的有效改善。实验发现“OFF” VIPER CAR系统加药后,分泌更少的与CRS相关细胞因子,小鼠的存活率也显著提高。
他们还将VIPER CARs与目前已有的临床相关药物门控CARs进行直接对比,证实VIPER CAR系统药物调控能力和体外杀伤能力最佳。
另外,鉴于VIPER CAR与其他临床相关药物门控CARs可以兼容,他们构建了靶向CD19和Her2的双靶向正交调控CAR。利用GZV调控的靶向CD19+细胞的“ON” VIPER CAR,联合POM(泊马度胺,来那度胺类似物)调控的靶向Her2+细胞的“OFF” VIPER CAR,通过两种药物的不同组合给药方式,实现了两种药物控制的、相互独立的双靶向抗肿瘤作用。
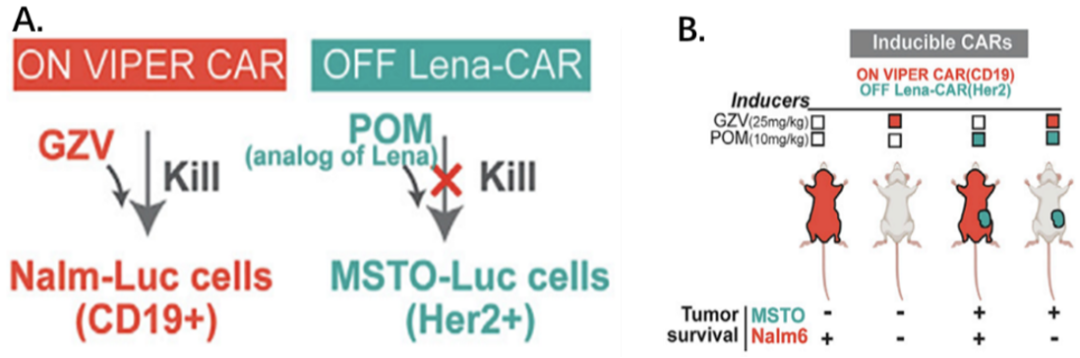
双靶向性药物门控CAR系统
最后,基于基础VIPER CAR他们进一步提出三种更复杂的“进阶版”二代VIPER CARs:
-
AND门控VIPER CAR:逻辑门中的“和”,提高CAR的特异性;
-
通用ON-OFF VIPER CAR:将VIPER CAR与靶向多种抗原的超级CAR结合,给予zipFv可以实现多抗原靶向杀伤,而在某个合适的时机给抑制NS3活性的药物,可以使得CAR活性丧失,由此实现既能靶向多种抗原,又能提高治疗安全性的可逆调控;
-
Switchboard VIPER CAR:靶向不同的抗原,并通过两种及以上药物实现可逆的多抗原靶向的调控。
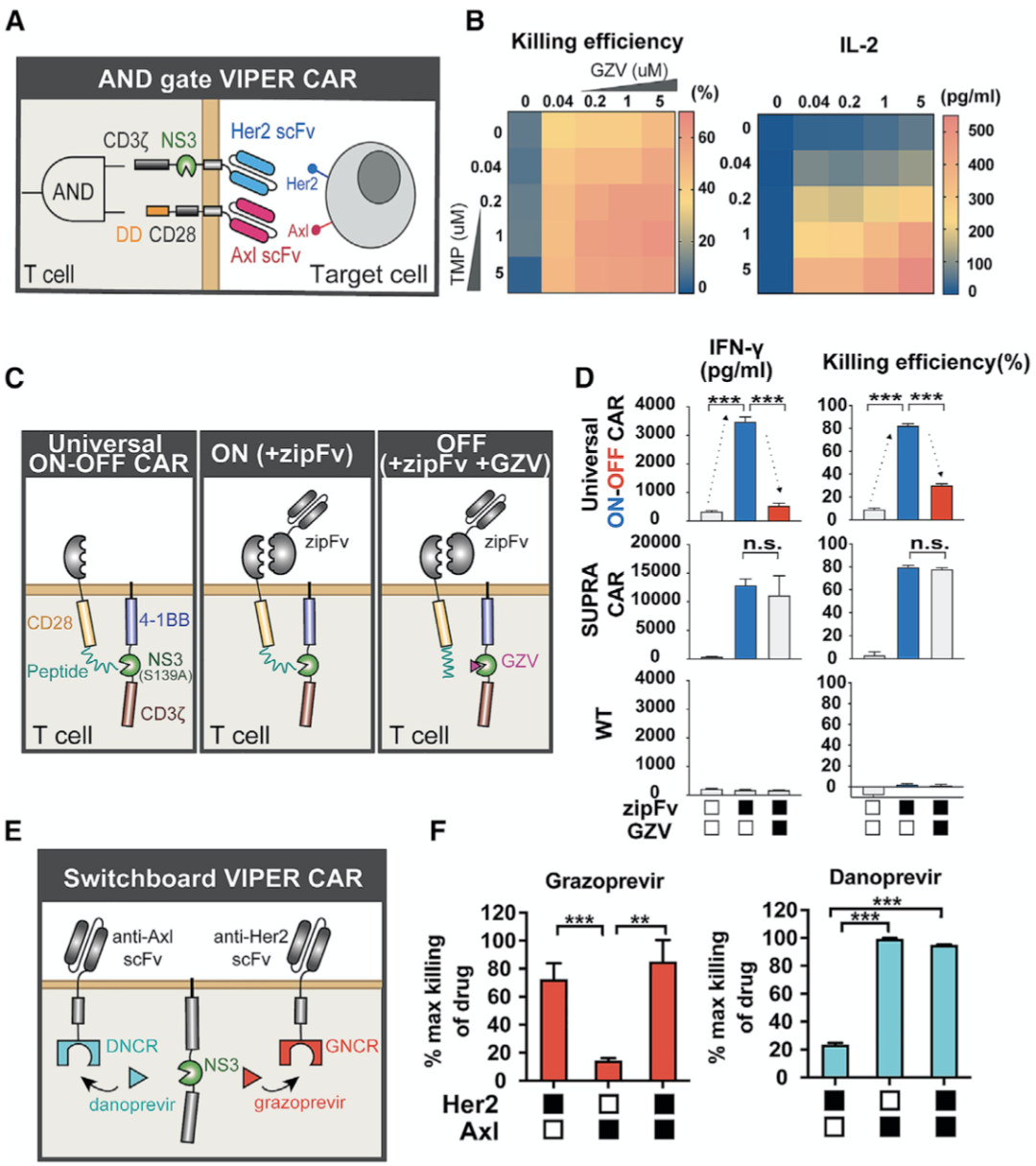
二代VIPER CAR系统
总的来说,Wong团队的这个研究利用已获FDA批准的药物,对CAR-T活性进行可逆调控,改善了传统CAR-T面临的CRS等不良反应,提高了治疗安全性。
此外,他们还在单一VIPER CAR系统的基础上,提出更复杂的二代VIPER CAR系统,展现了VIPER CAR系统的多样性,极大拓展了CAR-T细胞治疗应用的可能性,也为更多设计的诞生提供了思路。
作为两种已获批治疗药物的强强联合,相信其临床转化过程会更加迅速,期待该系统能更好、更快的造福患者。
参考文献:
[1].Labanieh L, Majzner RG, Klysz D, et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell. 2022;185(10):1745-1763.e22. doi:10.1016/j.cell.2022.03.041
[2].Wu CY, Roybal KT, Puchner EM, Onuffer J, Lim WA. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 2015;350(6258):aab4077. doi:10.1126/science.aab4077
[3].Li HS, Wong NM, Tague E, Ngo JT, Khalil AS, Wong WW. High-performance multiplex drug-gated CAR circuits [published online ahead of print, 2022 Aug 26]. Cancer Cell. 2022;S1535-6108(22)00372-5. doi:10.1016/j.ccell.2022.08.008
[4].Cao W, Geng ZZ, Wang N, et al. A Reversible Chemogenetic Switch for Chimeric Antigen Receptor T Cells. Angew Chem Int Ed Engl. 2022;61(10):e202109550. doi:10.1002/anie.202109550
[5].Labanieh L, Majzner RG, Klysz D, et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell. 2022;185(10):1745-1763.e22. doi:10.1016/j.cell.2022.03.041
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


