「癌细胞的生存之道」Nat Metab:新研究揭示癌细胞如何抵御化疗引起的饥饿和死亡
来源:生物谷原创 2024-12-13 10:45
在这项研究中,研究人员扫描了已知参与细胞代谢的3000个癌细胞基因,通过基因缺失确定哪些基因是癌细胞在化疗后存活所必需的。
虽然化疗成功地治疗了癌症并延长了许多患者的生命,但它并不总是对每个人都有效。癌细胞会重新调整它们将燃料转化为能量的代谢过程,以规避化疗药物的作用。许多化疗药物都是所谓的抗代谢药,旨在破坏肿瘤生长和存活所需的细胞过程。
最近,来自纽约大学、劳拉和艾萨克-珀尔穆特癌症中心以及马萨诸塞大学的研究人员揭示了癌细胞逃避化疗药物的两种方式。相关研究结果于2024年11月26日在线发表在Nature Metabolism期刊上,论文标题为“Glucose limitation protects cancer cells from apoptosis induced by pyrimidine restriction and replication inhibition”。

化疗药物与嘧啶合成
在这项研究中,研究人员使用了三种化疗药物:雷替曲塞(raltitrexed)、N-(膦酰乙酰)-L-天冬氨酸(PALA)和布喹那(brequinar)。这些药物能够阻止癌细胞制造嘧啶,而嘧啶是构成RNA和DNA的重要组成部分。癌细胞必须获得足够的嘧啶才能快速增殖和生长。某些化疗药物通过破坏嘧啶合成途径,使癌细胞迅速陷入饥饿状态,并最终导致细胞凋亡(apoptosis,即程序性细胞死亡)。
低糖环境下的生存策略
然而,癌细胞并不会轻易放弃。研究人员发现,在葡萄糖(血糖的化学术语)供应不足的情况下,癌细胞仍然能够找到生存的方法。这种低糖环境实际上减缓了尿苷核苷酸(uridine nucleotides)的消耗,从而降低了化疗药物的效果。正常情况下,尿苷核苷酸的制造和消耗是为了帮助构建遗传密码和促进细胞代谢。但当化疗药物阻断了DNA和RNA的合成时,尿苷核苷酸库的消耗也被阻断了,因为需要葡萄糖将尿苷的一种形式UTP转变成另一种可用的形式UDP-葡萄糖。
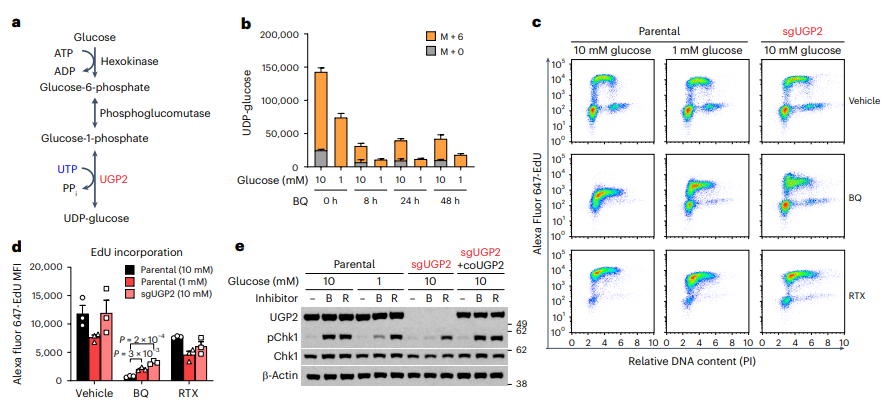
图:葡萄糖将UTP分流到UDP-葡萄糖合成途径,在抑制 DHODH 时会增加复制压力
低糖环境的影响
具有讽刺意味的是,低葡萄糖的肿瘤微环境反而减缓了细胞对尿苷核苷酸的消耗,从而可能减缓了癌细胞的死亡率。癌细胞需要耗尽包括尿苷核苷酸在内的嘧啶构成单元,然后才会自我毁灭。此外,低糖环境还无法激活位于线粒体表面的两种蛋白——BAX和BAK。这些蛋白被激活后会瓦解线粒体,并立即引发一系列有助于启动细胞凋亡的Caspase酶。
研究的意义
论文第一作者、纽约大学格罗斯曼医学院病理学系博士后研究员Minwoo Nam博士说:“我们的研究显示了癌细胞如何抵消低葡萄糖肿瘤微环境的影响,以及这些代谢变化如何最大限度地降低化疗药物的效果。我们的研究结果解释了肿瘤微环境中的代谢改变如何影响化疗的问题:低血糖减缓了尿苷核苷酸的消耗和耗竭,而这是促进癌细胞生长并阻碍其凋亡所必需的。”
Possemato教授指出,未来可以利用这些研究成果开发新的化疗或联合疗法,以改变癌细胞在低糖微环境中的反应,使其与在其他稳定葡萄糖微环境中的反应相同。此外,还可以开发诊断测试来测量患者的癌细胞如何最有可能对低血糖微环境产生反应,并预测患者对特定化疗药物的反应程度。
未来的方向
Possemato团队计划进一步研究阻断其他癌细胞通路如何触发细胞凋亡以应对这类化疗药物。他提到,一些实验性药物,如Chk-1抑制剂和ATR抑制剂,已经可以达到这一目的,但由于患者对这些药物的耐受性不佳,还需要研究更多的药物。
在这项研究中,研究人员扫描了已知参与细胞代谢的3000个癌细胞基因,通过基因缺失确定哪些基因是癌细胞在化疗后存活所必需的。他们发现,大多数对细胞在低糖肿瘤环境中存活至关重要的基因也参与了嘧啶合成,这是许多化疗药物所靶向的一个精确生物途径。因此,他们的实验重点是研究不同实验室培养的克隆癌细胞在化疗后对低葡萄糖的反应,以及糖含量降低会影响哪些其他化学过程。(生物谷Bioon.com)
参考资料:
Minwoo Nam et al. Glucose limitation protects cancer cells from apoptosis induced by pyrimidine restriction and replication inhibition. Nature Metabolism, 2024, doi:10.1038/s42255-024-01166-w.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


