新发现! 内皮过氧化物酶体增殖物激活受体促进缺血后血管修复
来源:本站原创 2022-03-20 18:45
下肢外周动脉疾病(PAD)是导致动脉粥样硬化性心血管疾病的第三大原因,仅次于冠状动脉疾病和中风。严重肢体缺血是PAD最严重的形式,可导致溃疡、坏疽和截肢。尽管有有效的治疗方法可以降低心血管风险,防止进展为严重肢体缺血,但PAD患者仍然没有得到足够的认识和治疗。
下肢外周动脉疾病(PAD)是导致动脉粥样硬化性心血管疾病的第三大原因,仅次于冠状动脉疾病和中风。严重肢体缺血是PAD最严重的形式,可导致溃疡、坏疽和截肢。尽管有有效的治疗方法可以降低心血管风险,防止进展为严重肢体缺血,但PAD患者仍然没有得到足够的认识和治疗。
为了促进缺血后血管的恢复,识别关键的内源性调节因子并探索增强其体内功能的途径是十分重要的。以往的研究表明,配体依赖的过氧化物酶体增殖物激活受体δ亚型(PPARδ)激活促进了血管生成。然而,低氧如何触发PPARδ及其在缺血后血管修复过程中的下游影响尚不清楚。
图片来源: https://pubmed.ncbi.nlm.nih.gov/35198077/
近日,香港中文大学的研究者们在Theranostics杂志上发表了题为“Endothelial PPARδ facilitates the post-ischemic vascular repair
through interaction with HIF1α”的文章,该研究揭示了低氧诱导的内皮细胞PPARδ非依赖于配体的激活稳定了HIF1α,并且是HIF1α激活的关键调节因子,以促进缺血后血管内稳态的恢复。
在本研究中,研究者首先发现了内皮PPARδ的缺失延迟了组织的灌注恢复和修复,伴随着缺血后血管生成的延迟,损害了血管完整性的恢复,更多的血管渗漏和炎症反应增强。在分子水平上,缺氧上调和激活内皮细胞中的PPARδ,而PPARδ相互稳定HIF1α蛋白,以防止其泛素介导的降解。
PPARδ直接与缺氧诱导因子1α (HIF1 α)的氧依赖降解结构域结合在PPARδ的配体依赖结构域上。重要的是,这种HIF α-PPARδ相互作用不依赖于PPARδ配体。腺相关病毒介导的稳定的HIF1α在体内的内皮靶向性过表达改善了小鼠后肢缺血后的灌注恢复,抑制了血管炎症,并增强了血管修复,以抵消PPARδ基因敲除的影响。
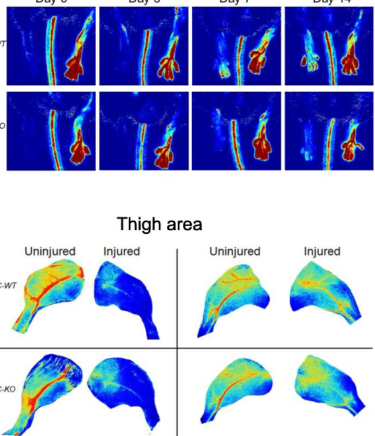
血管内皮细胞PPARδ缺失损害血管重塑和骨骼肌再生
图片来源:
https://pubmed.ncbi.nlm.nih.gov/35198077/
综上所述,研究者通过调节涉及血管生成、内皮屏障功能和血管炎症的基因调控网络,显示了内皮型PPARδ在血管内稳态和缺血后血管修复中的中心作用。PPARδ是由内皮细胞缺氧诱导的α,它可以相互促进HIF1的稳定性和反式激活。这些结果还提供了新的信息,即在低氧应激下,PPARδ通过与HIF1α的相互作用而在血管系统中以配体无关的方式激活。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



