Dev Cell:徐成冉团队揭示肝母细胞分化的表观遗传调控机制
来源:生物世界 2023-07-27 11:49
该研究揭示了肝脏发育过程中肝母细胞向肝实质细胞和胆管细胞分化的不同表观遗传学调控机制。
北京大学基础医学院、北大-清华生命科学联合中心、女性生育力促进全国重点实验室徐成冉课题组在 Developmental Cell 期刊发表了题为:The default and directed pathways of hepatoblast differentiation involve distinct epigenomic mechanisms 的研究论文。

细胞命运决定受到一系列遗传和表观遗传级联调控,包括基因转录、染色质可及性和组蛋白修饰等。虽然多组学分析已用于定义发育过程中细胞身份,但由于缺乏简单有效的系统,利用多组学方法揭示体内细胞分化发育路径的精确性及不同方法之间的相互关系并没有被有效研究。肝脏是重要的代谢器官,其主要的细胞类型肝实质细胞和胆管细胞在发育过程中起源于双潜能肝母细胞。
徐成冉课题组前期工作提出了肝母细胞分化的“默认-调控”新模型,即肝母细胞向肝实质细胞的发育是细胞命运默认的过程,而向胆管细胞分化是受到高度调控的。利用这一简洁且易操作的肝脏细胞体内分化系统,课题组探究了不同表观遗传修饰与细胞分化和发育路径的关联以及调控机制。
课题组选取了小鼠肝母细胞向肝实质细胞和胆管细胞发育的一系列时间点,利用RNA-seq、ATAC-seq和组蛋白修饰相关的ChIP-seq等多组学技术,分析了不同发育时期肝系细胞的动态表观遗传特征。结果显示转录组、染色质可及性及启动子相关组蛋白修饰H3K4me3和H3K27me3的动态变化能够有效地描绘出肝母细胞分化的“默认-调控”路径,而增强子相关组蛋白修饰H3K4me1和H3K27ac无法有效地描绘此路径。遗传学研究证明了启动子相关H3K27me3修饰酶Ezh2和Jmjd3在肝母细胞向胆管细胞分化中发挥相反的调控作用,而对肝母细胞向肝实质细胞分化无显著影响;而活性增强子相关的组蛋白乙酰转移酶p300调控肝母细胞分化后肝实质细胞和胆管细胞的成熟。因此,启动子和增强子相关的表观遗传调控在肝母细胞发育中分工合作,分别调控细胞的分化过程和成熟过程。
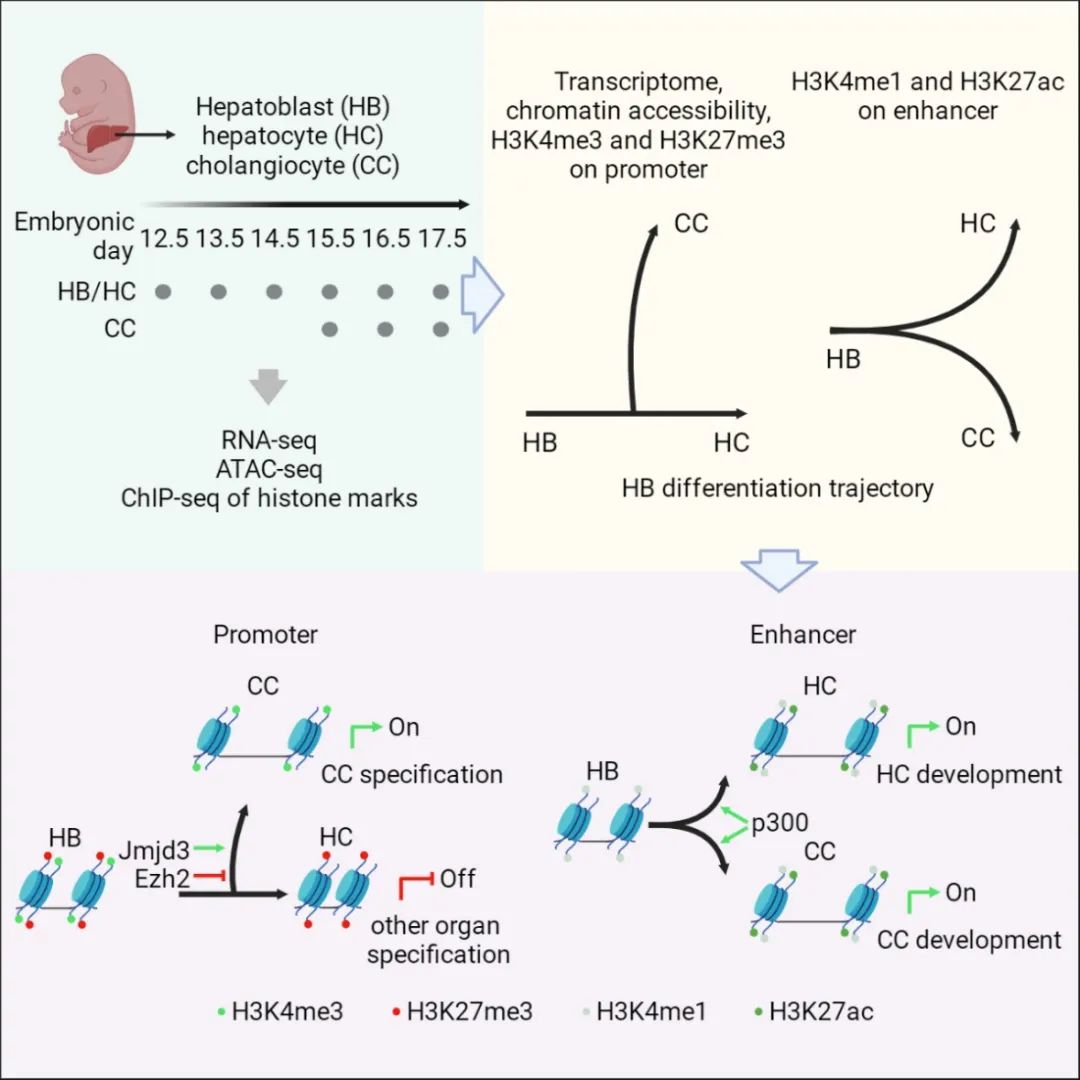
这项研究不仅为利用多组学解析细胞命运转变和发育建立了范式,也为体外优化肝脏细胞定向分化提供了重要的发育生物学信息。
北京大学基础医学院教授、生命科学联合中心研究员徐成冉为论文通讯作者,北京大学基础医学院博士后杨李和生命科学学院博士生王信为共同第一作者,北京大学基础医学院博士后于欣欣和周璧琛以及北京大学生命科学学院、生命科学联合中心、IDG麦戈文脑科学研究所杨竞教授和杨璐为本研究做出了重要贡献。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


