Cancer Cell:杨增杰团队开发基于甲状腺激素的儿童脑肿瘤分化治疗新策略
来源:生物世界 2024-09-02 15:15
该研究首次确立了TH/TRα1/EZH2/NeuroD1信号轴及其在促进肿瘤细胞终末分化和MB发病中的关键作用,提示甲状腺功能减退能够促进MB的发病。
髓母细胞瘤(MB)是儿童中最常见的恶性小脑肿瘤,目前认为髓母细胞瘤形成是在小脑神经元发育的早期胚胎阶段。MB至少包含四个分子亚型:WNT、Sonic Hedgehog(SHH)、Group 3和Group4。每个亚型都表现出独特的临床表现和遗传特征。
目前髓母细胞瘤的治疗包括多模式疗法,如手术后进行放疗和化疗。尽管采取了如此积极的治疗,但总体生存率仍然不如人意。由于当前治疗对发育中大脑的毒性,患者在治疗后终生伴随各种并发症,包括智力障碍、继发性恶性肿瘤、内分泌疾病和听力损伤。因此,迫切需要更有效且毒性更低的治疗方法来治疗MB, 从而提高生存率,改善生活质量。
前期研究揭示了MB生物学的一个关键方面:MB肿瘤细胞能够被诱导终末分化,这一过程表现为分化的肿瘤细胞能不可逆地退出细胞增殖周期以及肿瘤形成潜力的丧失。这表明诱导MB肿瘤细胞的终末分化可能成为一种有效的治疗策略。然而,要充分利用这一生物学特性,必须彻底理解控制MB肿瘤细胞分化的分子机制。
甲状腺激素(TH)对于胎儿和出生后中枢神经系统的发育至关重要。TH的活性形式3,5,30-三碘-L-甲状腺原氨酸,即T3,主要通过与核甲状腺激素受体(TR)的相互作用调节细胞分化与基因表达之间的相互作用, 直接影响细胞增殖。甲状腺功能减退症是MB患者中普遍存在的内分泌障碍,主要被认为是由于积极的肿瘤治疗,尤其是全脊柱照射所致。然而,甲状腺功能减退在MB致病性中的作用未被研究过。
美国Fox Chase癌症中心杨增杰教授团队(博士后杨一峻为论文第一作者)在 Cancer Cell 期刊发表了题为:Thyroid hormone suppresses medulloblastoma progression through promoting terminal differentiation of tumor cells 的研究论文。
该研究阐明了髓母细胞瘤(MB)肿瘤细胞终末分化的机制,并首次建立了甲状腺激素信号传导与MB进展之间的联系——证实通过促进肿瘤细胞分化可以后效地抑制MB进展。这一发现为T3作为一种有前景的治疗手段提供了有力的理论依据和实验基础。

该研究利用了髓母细胞瘤小鼠模型,首先发现了T3在体外促进小鼠MB肿瘤细胞进行终末分化,并以剂量依赖的方式减少细胞增殖。同时经T3预处理的小鼠来源的MB肿瘤细胞在小鼠体内原位移植后,发现其肿瘤形成潜力降低。
为了探究T3诱导MB肿瘤细胞终末分化机制,研究者发现,甲状腺激素核受体TRα1在小鼠和人类髓母细胞瘤细胞中均有表达,并且作为神经源性分化因子1(NeuroD1)的转录因子。当T3水平降低时,TRα1和EZH2相互结合通过组蛋白甲基化(H3K27m3)抑制NeuroD1在肿瘤细胞中的转录。T3干扰了TRα1和EZH2之间的相互作用,逆转了EZH2对NeuroD1的转录抑制,最终导致MB肿瘤细胞终末分化。为了证实这一点,他们展示了在使用T3或EZH2抑制剂处理MB肿瘤细胞后基因表达变化高度重叠,进一步验证了T3引发的分化机制是通过抑制EZH2介导的NeuroD1转录抑制实现的。
T3能显著抑制了体内MB肿瘤的生长。更重要的是,T3的显著抑瘤效果不仅限于SHH-MB(Sonic Hedgehog信号通路相关髓母细胞瘤),而且对Group3-MB同样有效。这些发现表明,T3的治疗效果不受MB亚型或致癌突变的限制,在MB各种亚型中具有广泛的应用潜力。此研究将T3治疗确立为一种创新且有前途的MB治疗策略,并突出了基于促进肿瘤分化的策略在治疗中的优势。
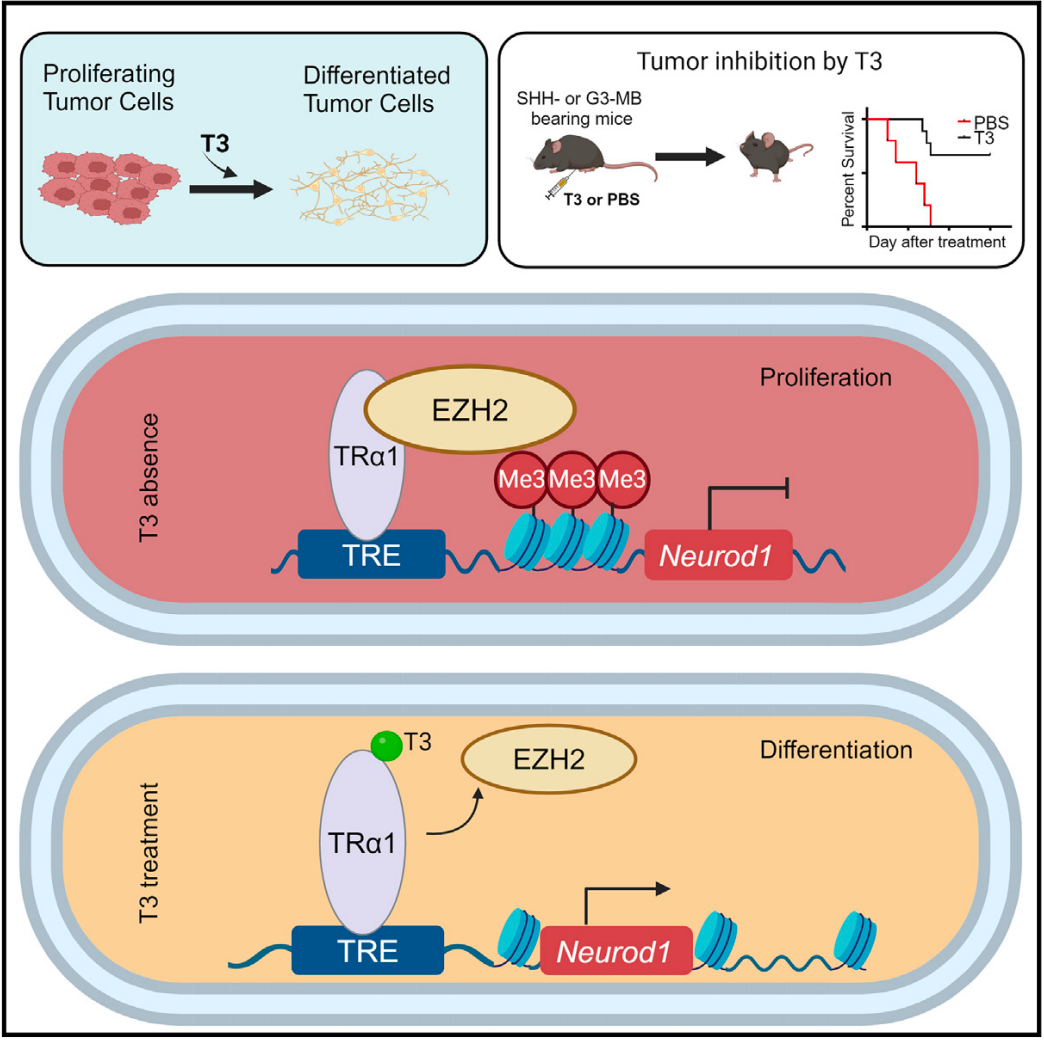
综上所述,该研究首次确立了TH/TRα1/EZH2/NeuroD1信号轴及其在促进肿瘤细胞终末分化和MB发病中的关键作用,提示甲状腺功能减退能够促进MB的发病。研究结果强调了在MB治疗中常规评估TH水平和甲状腺功能减退的重要性。此外,MB患者中普遍存在的甲状腺功能减退症进一步支持了将T3作为MB治疗的观点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


