《自然》:“海选”12000个基因,找到最强T细胞功能增强因子
来源:奇点糕 2022-04-29 12:14
由纽约大学Peter Smibert和Neville E. Sanjana领衔的研究团队在《自然》杂志上发表重要研究成果
相信大家对于CAR-T细胞疗法已经不陌生了,它对一些血液肿瘤有着极其显著的疗效,然而CAR-T细胞疗法在实体瘤治疗中收效甚微,甚至在血液肿瘤中除了急性B细胞白血病之外,大部分其他类型的血液肿瘤患者由于体内CAR-T细胞失活并没有出现持续性缓解[1]。
于是许多科学家们便致力于寻找会使T细胞失活的基因,及其涉及的生物学机制。但是有研究者反其道而行之。
近日,由纽约大学Peter Smibert和Neville E. Sanjana领衔的研究团队在《自然》杂志上发表重要研究成果[2]。
他们利用OverCITE-seq这一单细胞水平的高通量技术手段,测试了大约12000个人类基因组开放阅读框(ORF)的过表达,对T细胞的增殖以及功能的增强作用。他们找到了能增加T细胞活性和增殖能力的ORF,并证实将它们用于改造现有CAR-T细胞的嵌合抗原受体,能增强CAR-T细胞的抗癌能力。

论文截图
作为一种用于治疗癌症的“活”药物,已经有6款不同的CAR-T疗法被FDA批准上市[3],并且在血液肿瘤治疗中取得了非常显著的成效,有患者在接受治疗十年后都没有复发,甚至体内仍然有CAR-T细胞存在[4]。
即便如此,也还是有许多血液肿瘤患者治疗后并没有达到持续性缓解,其中最主要的原因就是回输体内的CAR-T细胞失活,进入耗竭状态[1]。
为了解决这个问题,许多科学家便转而去研究导致T细胞失活的生物学机制。例如通过CRISPR技术敲除基因组上的所有基因,来确定是哪些基因起了主导作用[5]。
由于基因数量太多,这种方式面临较大的挑战性,并且由于CRISPR系统自身的特性,可能会使得编辑后的T细胞受到患者自身免疫系统排斥[6]。
因此Peter Smibert和Neville E. Sanjana团队提出了一个完全不同的解决方案——既然CAR-T细胞在体内容易失活,那么就给它们加上能增强增殖能力和抗癌活性的基因,使得CAR-T细胞对癌细胞来说更具“侵略性”。
为了避免加入的基因在T细胞内无法正常表达,研究人员用慢病毒作为载体将大约12000个基因的全长序列,分别转导入三个健康捐献者的预刺激CD4+以及CD8+T细胞,这些基因平均每个带有6个用于后续识别的“条形码”(Barcode)。
将这些细胞体外培养14天后,对它们进行荧光标记,之后再次刺激使得T细胞增殖,随后通过比较刺激前后基因Barcode数量的变化,可以得到这些基因对T细胞增殖的影响。
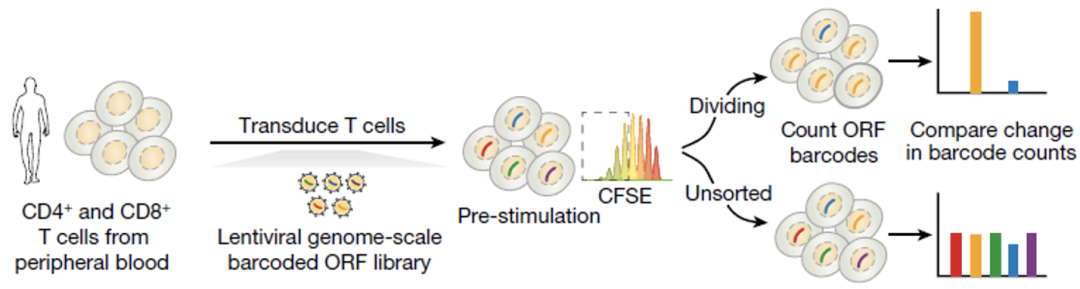
实验设计原理
在增强T细胞扩增能力排名靠前的基因(Top-ranked)中,有许多是已知能参与免疫过程的基因,包括MAPK3、BATF、IL12B以及IL23A等等[7]。这其中促进作用最大的基因是LTBR(编码淋巴毒素β受体),LTBR在基质和骨髓细胞中广泛表达,但几乎不在淋巴细胞中表达。
接着研究人员便进一步探究了33个Top-ranked基因对T细胞其他功能的影响,他们这次选择了一个缺少细胞内结构域的神经生长因子受体(tNGFR)作为对照,将tNGFR和33个基因分别利用载体转导进CD4+和CD8+T细胞中。
在经过和前面一样的实验流程之后,研究人员不仅比较了实验组和对照组之间T细胞扩增的差异,还同时比较了T细胞分泌细胞因子能力,以及表面活性标志物表达差异。
他们发现在CD4+和CD8+T细胞中,Top-ranked基因与增殖能力是高度相关的(r=0.61,p=0.002),并且其中大部分基因都会使得T细胞在激活后CD25和CD154的表达增加。
除此之外还有一些基因能增强T细胞分泌细胞因子的能力,最显著的基因仍然是LTBR,它能使得T细胞分泌的细胞因子增加5倍之多。

能促进T细胞分泌细胞因子的基因中,LTBR最强
到这里,研究人员已经证明了Top-ranked基因能够促进T细胞增殖、表面活性标志物表达以及细胞因子分泌,于是他们想知道这些基因发挥作用的具体机制。
Peter Smibert和Neville E. Sanjana团队开发了OverCITF-seq测序平台,对转导进T细胞的基因ORF表达量进行单细胞水平上的量化。这项技术的原理是设计一个针对基因ORF Barcode的RNA引物,来引导ORF的mRNA进行反转录,使得在RNA测序过程中,ORF能组成一个独立的cDNA文库,细胞中其他的基因则组成另一个cDNA文库。
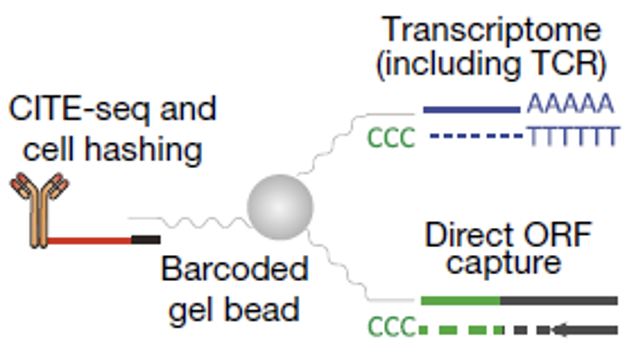
OverCITE的技术原理
利用OverCITE-seq技术,研究人员对来自同一个健康捐献者且分别转导了30个基因ORF的CD8+T细胞进行了测序,这些细胞一部分被按照之前的实验流程操作——经过了再次刺激过程,一部分则在转导后并没有再刺激,处于“休眠状态”。
将这些CD8+T细胞根据基因表达谱进行无监督聚类后,他们发现激活和未激活的T细胞可以很清晰地分成两类,同时两大类又可以分成10小类。其中一些种类是和特定的T细胞状态或功能相关的,表明同一类T细胞具有类似的状态或功能,例如类别1和细胞周期有关,类别10与T细胞的活化和增殖有关。
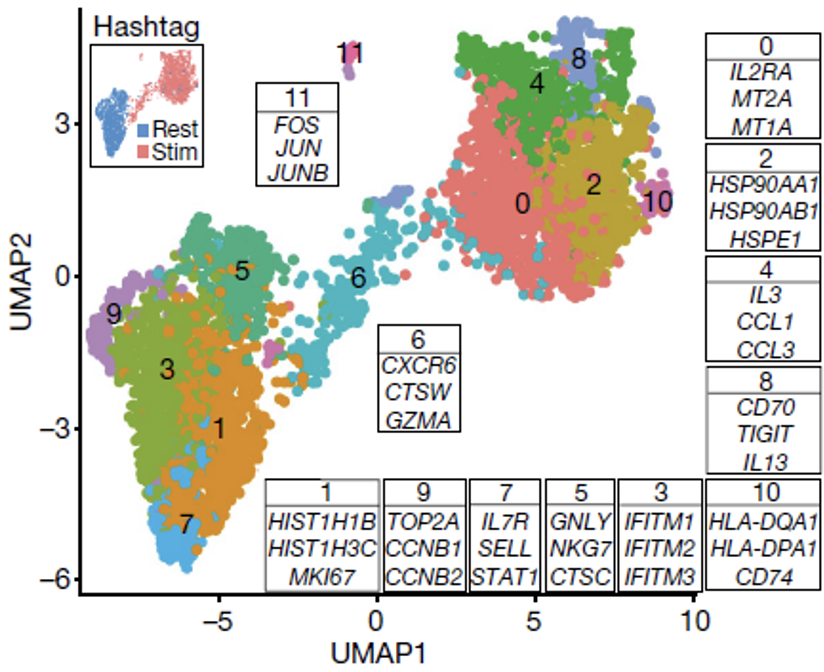
将T细胞根据基因表达谱进行聚类
然后研究人员分析了10种T细胞中转导的ORF富集情况,以确定ORF对细胞转录组的影响,发现在类别1中CDK1和CLIC1显著富集,类别10中则是LTBR显著富集。
结合上述不同种类T细胞与特定状态和功能的关系,这进一步表明LTBR通过重塑细胞转录组,从而实现既能促进T细胞增殖,又可以增强T细胞活性以及分泌细胞因子的能力。
既然LTBR可以凭一己之力重塑T细胞的转录组,那就很值得研究一下它是怎么做到的。
研究人员利用bulk-seq比较了分别转导LTBR和tNGFR的T细胞(下文称LTBR细胞和tNGFR细胞)之间的基因表达谱,发现LTBR细胞不仅上调MHC-Ⅰ和MHC-Ⅱ相关基因,还表达由CD74编码的MHC-Ⅱ恒定链,CD74已经被证明在B细胞中能够激活抗凋亡的NF-kB通路,同时LTBR细胞还上调BATF3,这是一个能促进CD8+T细胞生存的基因。
在后续的实验中,研究人员也发现与tNGFR细胞相比,LTBR细胞有更强的抗激活所诱导的细胞凋亡能力,以及在受到持续刺激的情况下保有更大的功能性,不容易进入耗竭状态。
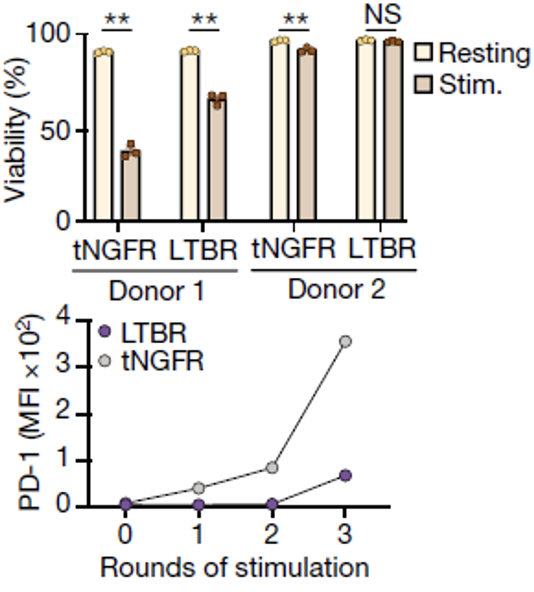
与tNGFR细胞相比,激活后的LTBR细胞有更强的抗凋亡能力(上);
LTBR在受到多次刺激后PD-1水平仍然较低(下)
说了这么多LTBR细胞的特征,再回到LTBR本身,它在骨髓细胞中表达,它涉及的信号通路是由LTA和LTB组成的三聚体或者LIGHT(由TNFSF14编码)激活的,而LTA、LTB以及LIGHT均由活化T细胞表达。
于是研究人员探究了激活后的LTBR细胞是否会受来自外部的上述三种分子的影响,结果发现LTBR细胞并不受影响,这表明LTBR的高表达尽管对T细胞有增强功能促进增殖的作用,但并不会驱动本身的活化。这也消除了一个临床应用上的安全问题——LTBR细胞不会因为外部环境而失去特异性识别肿瘤抗原的功能。
随后,为了找出LTBR的关键结构域,研究人员在LTBR序列中引入突变。总体上LTBR的N端比C端对于缺失突变更耐受,缺失393-435的残基对LTBR的功能几乎没有影响,而缺失377-435的残基则会让LTBR完全失去功能。
解析LTBR调控机制的探索仍在继续,研究人员利用ATAC-seq分析了LTBR细胞和tNGFR细胞的表观组学差异,发现NF-kB p65(RELA)是LTBR细胞中最富集的转录因子。同时他们观察到在受到刺激后LTBR细胞中NF-kB信号通路的p65(RELA)会快速磷酸化,而相应的抑制剂磷酸化水平也会升高,两者同时增强了NF-kB通路的活性,以及通路所涉及基因的转录活性。
除了经典的NF-kB通路,研究人员还发现了非经典NF-kB通路的p52(RELB)同样在LTBR细胞中富集,但是他们通过分别敲除两个信号通路相关基因结合bulk-seq分析发现,只有RELA的缺失会造成LTBR涉及通路的核心基因下调,而RELB的缺失并没有显著影响,表明LTBR极有可能是通过经典的NF-kB通路发挥作用的。
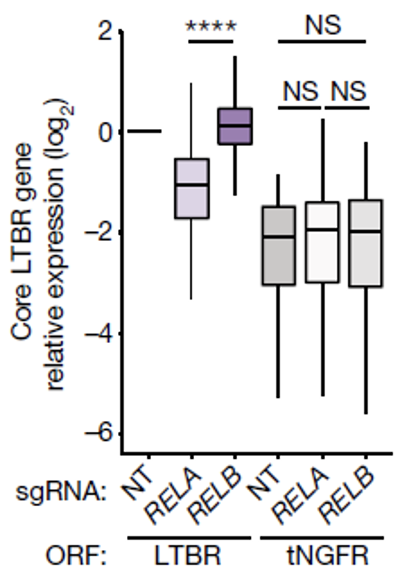
RELA的缺失会造成LTBR细胞核心基因下调,而RELB的缺失则不会
由于前面的实验中LTBR细胞和tNGFR细胞都是经过CD3/CD28的刺激活化,是没有特异性的激活过程,研究人员便想知道在特异性抗原刺激下LTBR细胞是否会出现和之前一样效果。
他们将一些Top-ranked基因与两款FDA批准的CAR-T疗法的CARs构建共表达载体对T细胞进行改造,这两种CARs都特异性靶向CD19,但一种CAR使用CD28作为共刺激域而另一种则使用4-1BB作为共刺激域。
在将改造后的CAR-T细胞与Nalm6(CD19+淋巴瘤细胞)共同培养之后,研究人员发现几乎所有的Top-ranked基因都促进了T细胞CD25的表达,以及抗原特异性细胞因子分泌。
尽管分泌细胞因子是T细胞抗肿瘤活性的重要指标,但还有一个关键部分是对肿瘤细胞的直接杀伤作用,也就是细胞毒性。与4-1BB CAR-T细胞相比Top-ranked基因对CD28 CAR-T细胞毒性的增强作用更大。并且表达LTBR的CAR-T细胞更不容易进入耗竭状态。
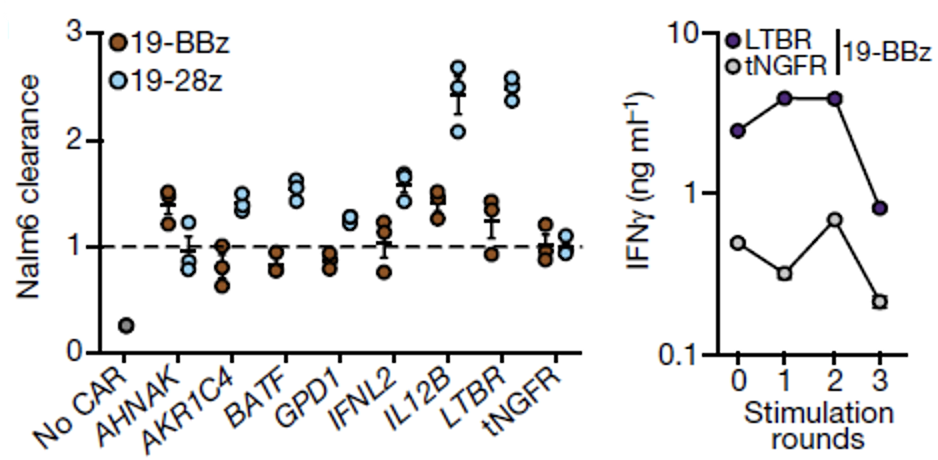
Top-ranked基因对CD28 CAR-T细胞的增强作用更大(左);表达LTBR的CAR-T细胞更能保持功能
考虑到上述所有实验的T细胞均来自于健康人,这些T细胞易于改造且不会在培养过程中失活,但事实上CAR-T细胞疗法改造的是肿瘤患者体内的T细胞。
因此研究人员采集了来自弥漫性大B细胞淋巴瘤患者的外周血,将LTBR和CARs转导进单核细胞,在与CD19+靶细胞共同培养后,他们发现LTBR CAR-T细胞因子分泌增加,和在健康人T细胞中观察到的现象一致。
值得一提的是,研究人员还尝试了在一种“非主流”T细胞——γδT细胞中进行上述改造实验,最后的结果仍然是改造后的T细胞分泌细胞因子的能力增强。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


