黑科技来袭!Nature:激活溶酶体铁,精准打击癌细胞,铁死亡有望为人类癌症治疗带来新的曙光
来源:生物谷原创 2025-05-15 10:32
本文研究中,研究人员通过设计和合成能够激活溶酶体铁的小分子药物 fentomycin,为癌症治疗提供了一种新的思路。
在癌症治疗的漫长征途中,科学家们一直在寻找能够精准打击癌细胞的新方法。近年来,“铁死亡”(Ferroptosis)这一概念逐渐成为研究热点。铁死亡是一种由铁催化的脂质过氧化引起的细胞死亡方式,与传统的细胞凋亡和坏死不同,其依赖于细胞内铁的活性。
近日,一篇发表在国际顶级杂志《Nature》上题为 “Activation of lysosomal iron triggers ferroptosis in cancer” 的研究报告中,来自法国科学研究中心(CNRS)等机构的科学家们通过研究探讨了铁死亡在癌症治疗中的潜力,特别是通过激活溶酶体铁来诱导癌细胞铁死亡的创新策略,为癌症治疗带来了新的曙光。

癌症是全球范围内的重大健康挑战,传统治疗方法如手术、化疗和放疗虽然在一定程度上有效,但往往伴随着严重的副作用和耐药性问题。近年来科学家们发现,癌细胞在某些状态下会表现出对铁死亡的敏感性,这就为开发新的癌症治疗策略提供了可能。
在这项研究中,研究人员设计并合成了一种能够靶向溶酶体铁的小分子药物 fentomycin,并验证了其在体内外的抗肿瘤效果。研究人员采用的实验对象包括多种人类和小鼠癌细胞系,如 HT-1080 纤维肉瘤细胞、MDA-MB-231 乳腺癌细胞、4T1 三阴性乳腺癌细胞等,以及从患者体内分离的原发性肿瘤细胞和肿瘤组织。
实验过程中,研究人员首先利用荧光标记技术观察了 fentomycin 在细胞内的分布情况,结果发现,其能特异性地积累在溶酶体中并与溶酶体内的铁发生相互作用从而激活铁的活性,并能引发脂质过氧化和细胞铁死亡。
不仅如此,研究人员还通过流式细胞术、荧光显微镜和脂质组学等技术,详细分析了 fentomycin 处理后细胞内铁含量、脂质过氧化水平以及细胞死亡情况的变化。研究发现,溶酶体铁离子能够诱发膜脂的氧化过程。在动物模型实验中,研究人员将 4T1 乳腺癌细胞移植到小鼠体内建立肿瘤模型,并通过淋巴结内注射的方式给予 fentomycin 治疗,实验结果表明, fentomycin 能显著抑制肿瘤的生长并延长小鼠的生存时间。
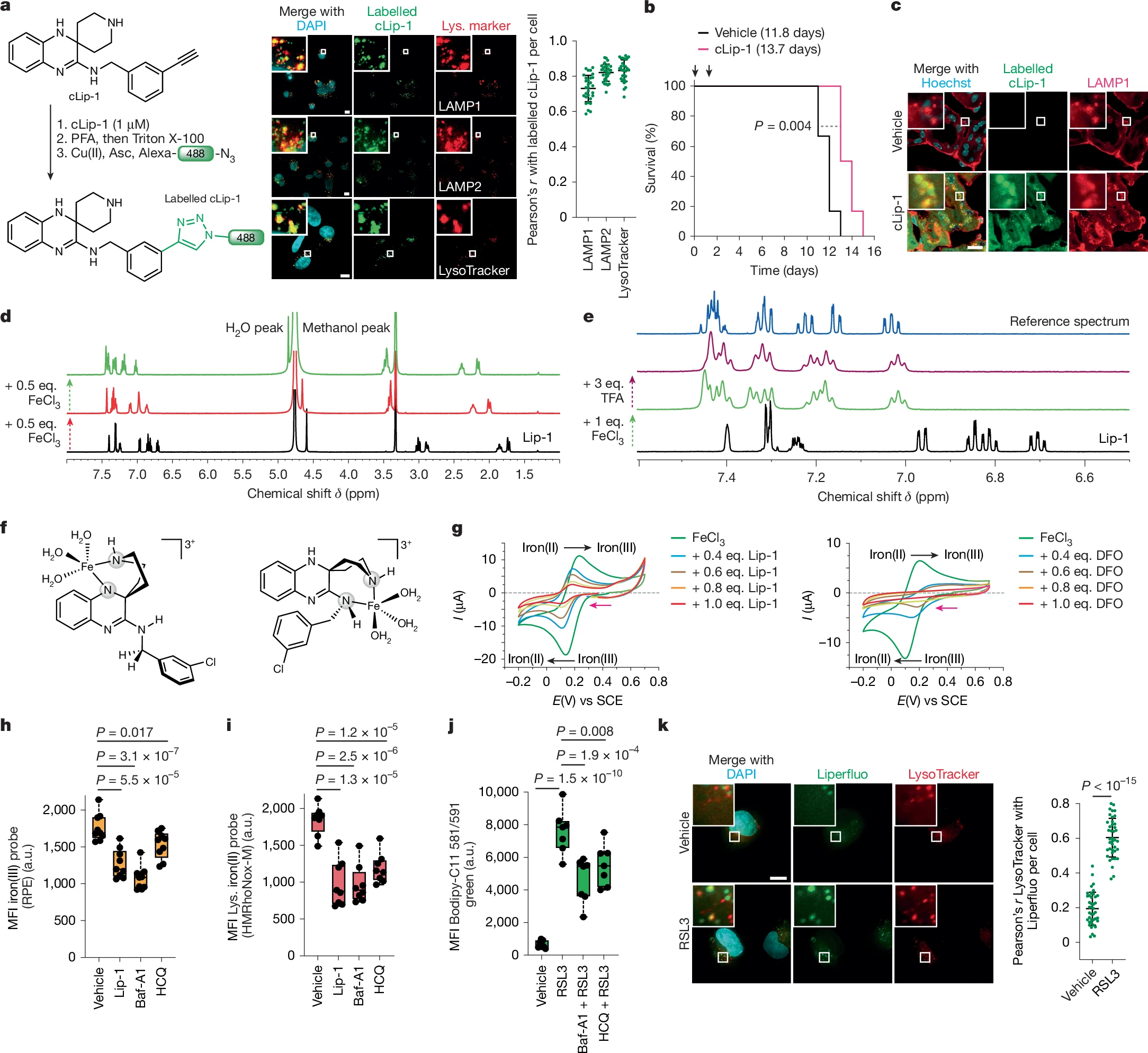
溶酶体铁离子或能诱发膜脂的氧化过程
研究者指出, fentomycin 能通过激活溶酶体铁来诱导癌细胞铁死亡,并在多种癌细胞系和小鼠肿瘤模型中展现出良好的抗肿瘤效果。此外他们还发现, fentomycin 对癌细胞的作用具有一定的细胞状态依赖性,特别是对于那些高表达铁摄取蛋白 CD44 的癌细胞亚群,其铁死亡诱导效果更为显著,这一发现为开发针对特定癌细胞亚群的精准治疗策略提供了重要依据。
然而,尽管 fentomycin 在实验中表现出了一定的治疗潜力,但其在临床应用中仍面临一些挑战。比如,如何确保药物在体内的有效递送和分布,以及如何避免对正常细胞的潜在毒性等问题,都需要在未来的研发过程中进一步解决。
综上,本文研究中,研究人员通过设计和合成能够激活溶酶体铁的小分子药物 fentomycin,为癌症治疗提供了一种新的思路。相关研究结果不仅证实了 fentomycin 在诱导癌细胞铁死亡方面的有效性,还揭示了其对特定癌细胞亚群的靶向作用机制。这一发现不仅为癌症治疗带来了新的希望,也为未来的研究提供了新的方向。
随着对铁死亡机制的进一步深入研究,相信科学家们能够开发出更加安全、有效的铁死亡诱导剂,为癌症患者带来更多的治疗选择。(生物谷Bioon.com)
参考文献:
Cañeque, T., Baron, L., Müller, S. et al. Activation of lysosomal iron triggers ferroptosis in cancer. Nature (2025). doi:10.1038/s41586-025-08974-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


