重磅级研究成果聚焦科学家们在单细胞研究领域取得的新进展!
来源:生物谷原创 2023-03-01 09:40
近年来,随着精准医学治疗时代的到来,单细胞研究领域正在不断推动人类癌症研究、代谢组学、发育生物学、免疫学及神经科学多个领域向前发展,逐渐成为生物医学领域研究的焦点。
近年来,随着精准医学治疗时代的到来,单细胞研究领域正在不断推动人类癌症研究、代谢组学、发育生物学、免疫学及神经科学多个领域向前发展,逐渐成为生物医学领域研究的焦点。本文中,小编就对近期科学家们在单细胞研究领域取得的重磅级研究成果进行整理,分享给大家!
【1】Nat Genet:科学家利用空间单细胞转录组学技术成功对人类的弥漫性中线胶质瘤进行了可视化研究
doi:10.1038/s41588-022-01236-3
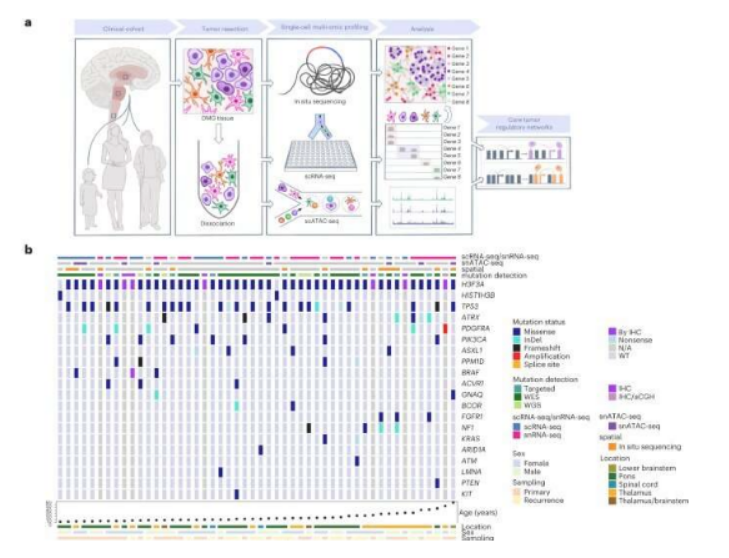
组蛋白3赖氨酸27-蛋氨酸(H3-K27M)突变最常发生在儿童脑桥的弥漫性中线胶质瘤(DMGs,diffuse midline gliomas)中,但其也在越来越多的成年人中被发现,目前研究人员并不清楚其在不同年龄和中线位置的潜在异质性。被诊断为弥漫性中线胶质瘤的患儿通常会在确诊后的1年内发生死亡,因为并没有有效的疗法治疗这种罕见的癌症,但如今研究人员或能对这种肿瘤更好地理解并有望开发出潜在的治疗性策略。近日,一篇发表在国际杂志Nature Genetics上题为“The landscape of tumor cell states and spatial organization in H3-K27M mutant diffuse midline glioma across age and location”的研究报告中,来自达纳-法伯/波士顿儿童癌症和血液病中心等机构的科学家们通过研究利用空间单细胞转录组学技术对不同年龄组和不同部位的癌细胞的结构进行了可视化研究。
p53或是科学家开发治疗人类唾液腺癌新型疗法的关键科学家利用空间单细胞转录组学技术成功
对人类的弥漫性中线胶质瘤进行了可视化研究。
图片来源:Nature Genetics (2022). DOI: 10.1038/s41588-022-01236-3
研究者发现,细胞的空间组织或能帮助解释为何弥漫性中线胶质瘤如何难以治疗,这项研究中,研究人员首次利用空间分辨率单细胞技术来对患者的组织进行分析,并强调了未来需要根据患者的肿瘤状况来开发专门化的治疗手段。研究人员重点对一种名为H3-K27M的突变所引起的弥漫性中线胶质瘤进行研究,H3-K27M会驱动大脑中的早期干细胞发生癌变。
随后研究者Filbin及其同事通过测定来自50名携带H3-K27M突变的个体(2-68岁之间)机体组织中的基因活性,从而寻找年龄和位点依赖性的差异;研究者发现,儿童肿瘤以及脑干和脊髓中的肿瘤中含有更多的不成熟细胞,这些不成熟的细胞会快速增且很容易的增殖,因为其类似于干细胞,这或许就能帮助解释儿童中弥漫性中线胶质瘤的致死性。此外,研究者还注意到,成年人机体的肿瘤含有更多间质样细胞,这些细胞通常有助于帮助愈合受损的组织并帮助促进肿瘤生长和癌症进展,然而,研究人员并未发现引起这种差异背后的遗传性原因。
【2】Nature:揭示癌症中突变过程诱导的单细胞基因组变异
doi:10.1038/s41586-022-05249-0
近日,一篇发表在国际杂志Nature上题为“Single-cell genomic variation induced by mutational processes in cancer”的研究报告中,来自美国威尔康奈尔医学院等机构的研究人员利用单细胞测序揭示了乳腺癌和卵巢癌相关的突变过程。在这篇论文中,他们描述了他们如何对成千上万个乳腺组织细胞进行单细胞基因组测序,并将他们的发现与他们对成千上万个卵巢肿瘤和乳腺肿瘤细胞样本进行的测序进行比较。
这些作者在注意到可能在多种癌症中引发基因组不稳定的细胞间拷贝数改变还没有被科学界很好地解决后开始了他们的研究。他们还注意到,在不同种类癌症的进化过程中,这种改变能够导致表型变化的方式也没有得到充分的研究。为了纠正这种情况,他们开始了一项雄心勃勃的测序工作,最直接地关注与卵巢癌和乳腺癌有关的突变过程。
这些作者的研究工作是双管齐下的。其中的一项实验涉及对13800个乳腺上皮细胞进行单细胞基因组测序,这些细胞来自可能存在或不存在p53、BRCA1或BRCA2突变的女性,这些突变会导致同源重组缺陷。他们随后通过观察单倍型模式和单细胞结构变异(structural variant)来寻找突变过程。第二项实验是对22057个晚期卵巢癌或乳腺癌的肿瘤细胞进行单细胞基因组测序。他们随后将在第一项实验中发现的模式(他们称之为前景事件)与第二项实验中发现的模式进行了比较。
【3】Nature子刊:腾讯AI Lab发布scBERT模型,攻克单细胞测序数据分析痛点
doi:10.1038/s42256-022-00534-z
单细胞测序技术是生命科学领域的一项革命性技术。可以细粒度地观察和刻画各个物种中组织、器官和有机体中单细胞分子图谱(细胞表达),便于更好地了解肿瘤微环境,以达到精细分析病因、精准匹配治疗方案的效果,对于「精准医疗」具有极高的应用价值。受数据样本量小、人工干预多、过度依赖 marker gene(已报道的特异性基因)等因素的影响,单细胞测序细胞类型注释技术一直面临着泛化性、可解释性、稳定性均比较低的问题,现存的算法难以有更广泛的应用。
近日,一篇发表在国际杂志Nature Machine Intelligence上题为“scBERT as a Large-scale Pretrained Deep Language Model for Cell Type Annotation of Single-cell RNA-seq Data”的研究报告中,来自腾讯AI Lab等机构的科学家们通过研究创新性地提出关于单细胞注释的 scBERT 算法模型,实现了高解释性、高泛化性、高稳定性的单细胞类型注释技术。这项研究成果对于单细胞转录组测序数据分析领域未来研究具有深远意义。
从结果上来看,scBERT模型实现了高解释性、高泛化性、高稳定性的单细胞类型注释技术。截至目前,通过了9个独立数据集、超过50万个细胞、覆盖17种主要人体器官和主流测序技术组成的大规模benchmarking测试数据集上,该算法模型的优越性均得以验证。其中,在极具挑战的外周血细胞亚型细分任务上,相较现有最优方法的70%准确度提升了7%。在应用价值层面,该项技术能给细胞中的每个基因都印上专属「身份证」,可用于临床单细胞测序数据,并辅助医生描述准确的肿瘤微环境、检测出微量癌细胞,从而实现个性化治疗方案或者癌症早筛。同时,对疾病致病机制分析、耐药性、药物靶点发现、预后分析、免疫疗法设计等领域都具有极其重要的作用。
【4】Science:通过单细胞分析揭示蝾螈端脑的神经发生和再生
doi:10.1126/science.abp9262
诸如墨西哥蝾螈(axolotl, 学名Ambystoma mexicanum)之类的蝾螈在研究四足动物保守性状方面发挥了作用。到目前为止,对蝾螈大脑的细胞类型多样性及其与其他脊椎动物大脑的关系的研究主要是通过组织学来进行的。墨西哥蝾螈的大脑在胚胎后的生活中生长,新的神经元由增殖性的室管膜胶质细胞(ependymoglia cell)产生。墨西哥蝾螈的大脑在受伤后也会再生;然而,目前仍不清楚干细胞如何再生这种蝾螈的大脑以及神经元连接是否得到适当的恢复。
对端脑的单细胞和单核基因组分析揭示了几种羊膜动物(包括爬行动物、鸟类和哺乳动物)的细胞类型和大脑区域的多样性和进化关系。这些方法还揭示了发育期间和成年时期神经发生的分子轨迹。近日,一篇发表在国际杂志Science上题为“Single-cell analyses of axolotl telencephalon organization, neurogenesis, and regeneration”的研究报告中,来自奥地利维也纳生物中心等机构的科学家们通过研究对墨西哥蝾螈端脑的细胞类型、神经发生和进化保守性进行了分子表征。他们将单核基因组分析应用于稳定状态下和再生期间的墨西哥蝾螈端脑,以研究它的细胞类型的多样性和稳态神经发生的分子动态。他们比较了分子谱,以了解再生性神经发生的损伤特异性特征。
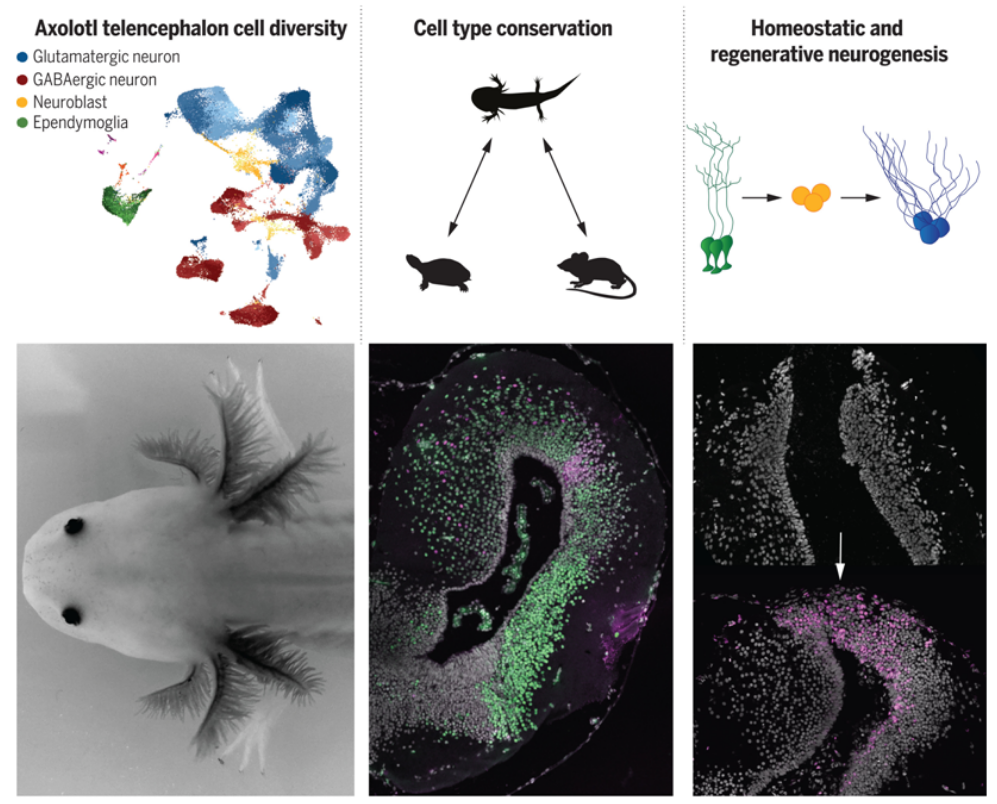
蝾螈端脑的结构、保守性和神经发生
图片来源:Science, 2022, doi:10.1126/science.abp9262。
文章中,研究人员利用单核RNA测序(snRNA-seq)和snATAC-seq以及空间转录组学,确定了墨西哥蝾螈端脑的细胞多样性。他们确定了区域分布的神经元、室管膜胶质细胞和神经母细胞(neuroblast)群体,并通过比较分析确定了它们在羊膜动物中的保守性。他们发现墨西哥蝾螈端脑含有谷氨酸能神经元(glutamatergic neuron),它们的转录与乌龟和小鼠海马体、背皮层和嗅皮层的神经元相似。
【5】Cell Discov:西湖大学科学家利用单细胞多组学技术揭示肾透明细胞癌中的关键调控程序
doi:10.1038/s41421-022-00415-0
肾透明细胞癌(clear cell renal carcinoma, ccRCC)是肾细胞癌中最常见和最具侵袭性的亚型。当前多种临床治疗策略,如靶向治疗和免疫治疗,仍然还无法很好地应对高度异质性的肿瘤微环境,所以在临床上并没有取得令人满意的治疗效果。深入刻画ccRCC微环境中的细胞组成和基因组调控特征对于我们理解肿瘤致病机理和开发新的治疗策略具有重要意义。
近年来,单细胞测序技术飞速发展,已经能够检测出单个细胞的基因转录表达和表观基因组调控等多种维度的信息。近日,一篇发表在国际杂志Cell Discovery上题为“Single-cell multiomics analysis reveals regulatory programs in clear cell renal cell carcinoma”的研究报告中,来自西湖大学等机构的科学家们通过研究对ccRCC在单细胞水平进行了多维度的探索。该研究整合了single-cell RNA-seq(scRNA-seq)和single-cell ATAC-seq(scATAC-seq)数据,描绘了ccRCC的转录组和表观基因组图谱,识别了在肿瘤细胞和多种免疫细胞中发挥重要作用的调控因子,进一步阐明了ccRCC的异质性并发现了潜在的治疗靶点。
该研究对ccRCC患者的肿瘤组织进行了配对的scRNA-seq和scATAC-seq测序,分别获得了38097和21272个单细胞。通过单细胞数据分析,识别了多种淋巴细胞和髓系细胞亚群。联合ccRCC标志基因CA9和拷贝数变异特征,在两种数据类型中各鉴定出了一个肿瘤细胞群体。总的来说,免疫细胞是ccRCC微环境中主要的细胞群体(>70%),肿瘤细胞只占不到10%。
【6】Nat Genet:科学家利用小鼠发育的单细胞图谱确定细胞命运调控程序
doi:10.1038/s41588-022-01118-8
多细胞生物的发育过程的稳健性表明有一个专门的调控程序来控制细胞命运决定的轨迹。根据Waddington的表观遗传景观理论,分化的细胞类型来自不稳定的干/祖细胞状态,并最终进入稳定的细胞状态。从单细胞数据中得出的状态流形(state manifold)的新兴概念进一步增强了我们对谱系进展的理解。这些状态流形背后的基因调控程序是什么?它们是如何被调控的?这两个问题在这个领域仍然是个谜。
中国浙江大学的研究者Guo Guoji等人长期致力于单细胞测序和细胞命运决定的研究。他们开发了Microwell-seq,即一种使用简单和廉价设备的高通量和低成本的scRNA-seq平台。利用Microwell-seq,他们构建了世界上第一个小鼠细胞图谱和人类细胞景观,分别于2018年和2020年发表在Cell期刊和Nature期刊上。在此基础上,这个研究团队在一项新的研究中对小鼠进行了从早期胚胎阶段到成熟成体阶段的七个生命阶段的单细胞转录组分析。他们总共分析了52万多个细胞,并确定了参与小鼠核心命运决定回路的谱系共同主调节因子和谱系特异性主调节因子。相关研究结果“Systematic identification of cell-fate regulatory programs using a single-cell atlas of mouse development”发表在了Nature Genetics杂志上。
在这项新的研究中,这个研究团队分析了小鼠在从早期胚胎阶段到成熟成体阶段的不同阶段---胎龄(E)10.5、E12.5、E14.5、出生当天(P0)、出生后第10天(P10)、出生后第21天(P21)和成年(6~10周)---的基因表达变化。所分析的器官涉及神经系统、呼吸系统、消化系统、循环系统、泌尿系统和生殖系统。实验显示,在谱系发育过程中,转录的可塑性逐渐降低。这个研究团队构建了一个系统性的转录因子调控网络,确定了900多个调控子(regulon),并确定了15种不同的表达模式,包括谱系共同调控程序和谱系特异性调控程序。他们比较了不同细胞谱系的分化特异性,确定了细胞命运决定的共同调控因子。
【7】Sci Adv:单细胞多组学分析或为开发新型CAR-T细胞疗法提供新的思路
doi:10.1126/sciadv.abj2820
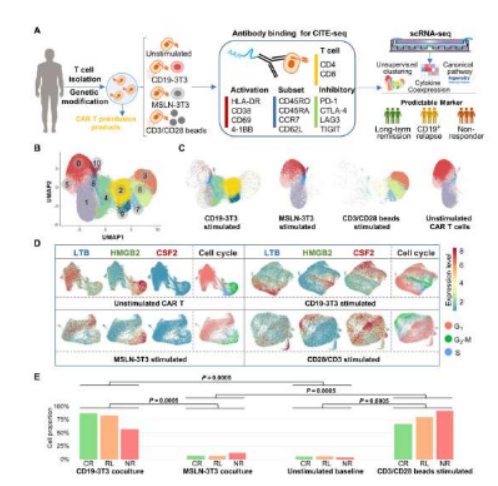
在过去10年里,一种称之为CAR-T细胞疗法的癌症疗法在治疗血液癌症上展现出了巨大的前景,但通常情况下患者往往会在短时间内出现疾病复发。近日,一篇发表在国际杂志Science Advances上题为“Single-cell antigen-specific landscape of CAR T infusion product identifies determinants of CD19-positive relapse in patients with ALL”的研究报告中,来自耶鲁大学等机构的科学家们揭示了其中一些关键的线索来解释为何患者会出现癌症复发。
单细胞多组学分析或为开发新型CAR-T细胞疗法提供新的思路。
原始出处:Science Advances (2022). DOI:10.1126/sciadv.abj2820
CAR-T细胞疗法主要涉及从患者机体的血液中分离出抵御病毒的T细胞,并利用嵌合抗原受体(CAR)对其进行遗传性修饰,CAR能靶向作用癌细胞表面表达的标志物,这些CAR-T细胞随后就会被重新输注到患者体内来抵御癌细胞,实践证明,其能有效抵御多种血液癌症,比如急性淋巴细胞性白血病(ALL)、淋巴瘤和多发性骨髓瘤,然而,很多患者都会在短期内出现疾病的缓解,30%-60%接受治疗的患者都会在1年内出现疾病的复发。为此,研究人员开始着手分析疾病长期缓解的患者和疾病复发的患者之间的差异,他们寻找了患者机体细胞的模式,并分析了12名儿童ALL患者机体的10万个单一的CAR-T细胞,在12名患者中,有5名患者在长达5年多的时间里疾病得到了完全缓解,另外5名患者则在试验过程中发生了疾病复发,其中位时间点为9.6个月,另外2名受试者并没有显示出对该疗法的客观反应。
文章中,研究人员使用了所谓的多组学方法,即将来自转录组和蛋白质组的数据结合,从而进行了强大的单细胞分析,这样他们就能密切研究每个细胞的基因表达特性,并识别出CAR-T细胞中隐藏的分子机制,其在未来癌症疗法的开发过程中扮演着关键角色。研究人员还识别出了一种共表达的细胞因子组件,其能作为免疫系统的信使而分泌特殊蛋白质,同时其还是协调免疫细胞的关键调节子,在这些细胞因子中,研究者发现了一组能代表T辅助2细胞(Th2)功能的细胞因子在疾病已经缓解了5年或更长时间的患者的细胞谱中非常突出,Th2细胞是介导机体免疫反应激活和维持的一种细胞亚型,这样研究人员就能更好地评估来自不同患者机体的CAR-T细胞的功能差异。
【8】Science:微生物单细胞时代正式开启 微生物高通量单细胞基因组学
doi:10.1126/science.abm1483
近日,一篇发表在国际杂志Science上题为“High-throughput, single-microbe genomics with strain resolution, applied to a human gut microbiome”的研究报告中,来自哈佛大学等机构的科学家们在微生物群落研究方法学上取得重要突破,文章中,他们发明了一种名为“Microbe-seq”的微生物高通量单细胞基因组学技术。
Microbe-seq技术集成了多种液滴微流控操作技术和定制开发的生物信息学分析手段,不需要培养即可从复杂微生物群落中获取成千上万个单细胞微生物的基因组信息,并组装出高质量的菌株水平基因组,从而能够在不损失分辨率或广泛物种适用性的基础上探究微生物群落的基因组。该方法应用面广泛,可用于具有复杂微生物群落的样本,如粪便、土壤和海洋等,在微生态研究中具有极大的市场应用潜力。
Microbe-seq技术集成了多种液滴微流控操作技术和定制开发的生物信息学分析手段,不需要培养即可从复杂微生物群落中获取成千上万个单细胞微生物的基因组信息,并组装出高质量的菌株水平基因组(包含大量尚未被培养的菌株),从而能够在不损失分辨率或广泛物种适用性的基础上探究微生物群落的基因组。同时,该技术还可精确解析菌株水平基因组、发现未培养的潜在的新菌株;进而可在菌株水平对HGT、宿主-噬菌体关联、功能基因和代谢通路进行深入研究。该方法可同时适用于其它复杂的微生物群落,如土壤和海洋中的微生物群落,有望成为医学和环境微生态研究的主流技术,对于发掘有潜在应用价值的微生物资源、探究种间/种内关系具有重要的理论和现实意义。
【9】Science:构建出迄今为止最为庞大的多种人类器官的单细胞图谱
doi:10.1126/science.abl4896
除了极少数例外,我们每个人身体里的数万亿个细胞都携带着基本相同的人类基因组,每个人类基因组包含2万到2.5万个蛋白编码基因。但是,为了执行使生命成为可能的专门功能,像肾脏、肺部、心脏和大脑这样的器官依赖于由独特的细胞类型构建的组织,当每个细胞类型发育到只表达基因组中的特定基因子集时,就会出现这种情况。
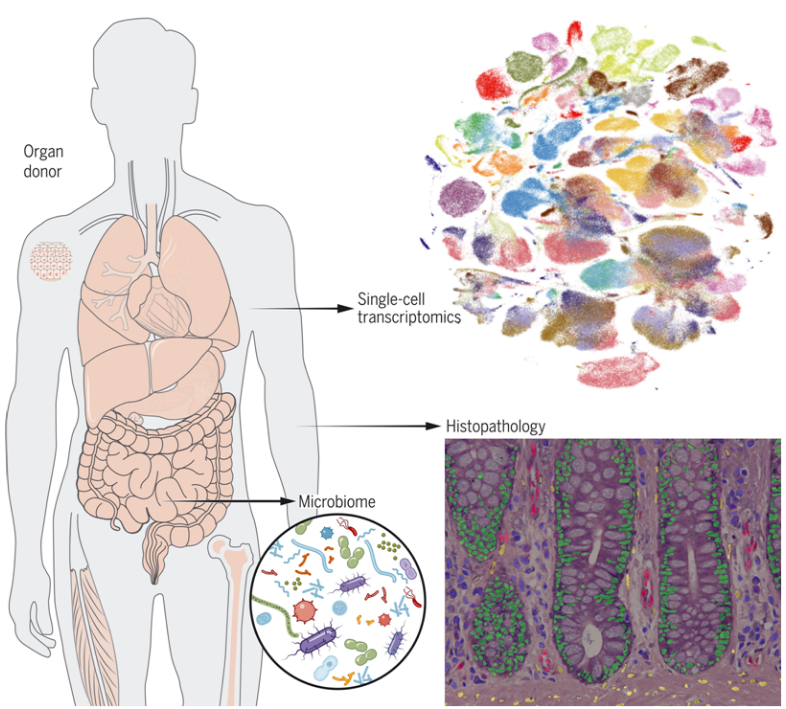
在此之前,不同细胞类型的基因表达多样性,即所谓的转录组(transcriptome),一直难以破译。但随着单细胞生物学的迅速发展,科学家们已经开发出一些工具和技术,精确地揭示了构成组织和器官的不同细胞所表达的基因。除了带来对正常生物学的更深理解,这些单细胞方法有望为新的治疗方法开辟途径,因为疾病通常会袭击特定的细胞类型。近日,一篇发表在国际杂志Science上题为“The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans”的研究报告中,来自Tabula Sapiens联盟的科学家们通过研究公布了一个巨大的数字图谱,绘制了来自24种人类组织和器官的近50万个细胞的基因表达,包括肺部、皮肤、心脏和血液。
Tabula Sapiens细胞图谱
图片来源:Science, 2022, doi:10.1126/science.abl4896。
Tabula Sapiens细胞图谱是包括来自同一人类供者的多种组织的最大图谱,也是第一个包括组织的组织学图像的图谱,并纳入了生活在组成肠道不同区室的人类细胞周围的微生物群落的细节。研究者Stephen Quake博士表示,这些数据的质量和广度是无可比拟的。这个图谱将使科学家们能够提出并回答他们以前从未接触过的有关人类健康和疾病的问题。
【10】Nature子刊:韩敬东团队提出基于Transformer的单细胞可解释注释方法
doi:10.1038/s41467-023-35923-4
近年来得益于单细胞测序技术的发展,我们可以以单细胞分辨率去理解生物学过程,包括发育,衰老和疾病等。细胞类型注释在单细胞数据分析过程中非常关键,传统的注释方法是将细胞降维到去除批次效应的低维空间,再进行一轮或多轮不同分辨率的聚类,最后根据不同细胞簇的标记基因人工的标注细胞类型。这一过程缺乏公认的标准,很大程度上受到研究人员偏好的影响。此外,移除批次效应的同时保留生物学差异也是单细胞研究的难点。幸而,随着技术进步,越来越多大规模单细胞图谱产生并公开发表,为后续研究提供了重要参考,但同时也产生了开发能够高效处理大规模数据的计算工具的需求。所以,统一标准的,高效的,生物学可解释的细胞类型标注工具对于单细胞分析结果的可重复性和科学研究的持续发展至关重要。
近日,一篇发表在国际杂志Nature Communications上题为“Transformer for One Stop Interpretable Cell type Annotation”的研究报告中,来自北京大学等机构的科学家们通过研究开创性地提出了基于多头自注意力机制的深度学习方法TOSICA,实现了无需任何批次信息输入,使用个人电脑,在数十分钟内对百万级单细胞数据的细胞类型注释,并建立多层次可解释性的,批次不敏感的,高分辨率的细胞低维表示。
与基于特征基因或相关性的机器学习方法相比,深度学习方法往往更适合处理大数据,更高效,更自动化。目前已经有大量基于自编码器(Autoencoder,AE)及其各种变体的细胞类型注释方法被开发,但受限于AE模型结构本身带来的弊端,此类方法大多伴随着特征提取过程中的信息损失,需要额外批次信息的辅助去除批次效应,以及无法在不牺牲模型深度或能力的情况下赋予隐空间生物学可解释性等问题。
Transformer是一种先进的,基于多头自注意力(Multi-head self-attention)机制的深度学习模型,拥有强大的全局信息集成能力和可解释性,它在自然语言处理(NLP)和计算机视觉(CV)等领域都取得了突破性进展。受这些优良特性的鼓舞,TOSICA 开创性的将Transformer计算单元运用到scRNA-seq数据分析领域。该模型首先将细胞中基因的表达信息转化成基因集特征(Gene set token)并添加一维用于分类的分类头(Class token),由于基因集间的离散特性,相对于传统Transformer模型,TOSICA无需位置信息编码(position embedding)而直接进入多头自注意力层进行特征集成,最后仅将class token接入分类器中得到细胞分类结果。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


