PNAS: 发现钾离子通道调控新机制
来源:脑智卓越中心 2023-01-11 10:58
线虫的UNC-103钾通道与hERG通道高度同源,参与调控线虫的运动和产卵等行为。研究利用表达UNC-103的线虫进行正向遗传学筛选,发现线虫DNA拓扑异构酶2相关蛋白PATR-1调控UNC-103通
《美国国家科学院院刊》(PNAS)在线发表了题为DNA topoisomerase 2-associated proteins PATL1 and PATL2 regulate the biogenesis of hERG K+ channels的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)蔡时青研究组完成。科研人员利用秀丽隐杆线虫的遗传学优势,通过正向遗传学筛选鉴定hERG通道生成(Biogenesis)的调控因子,发现DNA拓扑异构酶2相关蛋白PATL1和PATL2调控hERG通道基因的转录。
人类ether-a-go-go相关基因(human ether-a-go-go related gene)编码一种内向整流电压门控型的钾离子通道(简称hERG)。该通道分布较为广泛,在心脏和神经系统中发挥重要的生理功能。hERG通道的生成过程包括转录、转录后、翻译和翻译后修饰等过程都受到精确调控。如果这些调控机制出现偏差,致使细胞膜上的hERG通道过多或过少,均会导致一些严重的人类疾病,例如2型长QT综合征、精神分裂症和癌症等。因此,解析hERG通道生物生成的分子机制可为探究与hERG通道功能障碍相关的人类疾病的病理学提供新线索。
线虫的UNC-103钾通道与hERG通道高度同源,参与调控线虫的运动和产卵等行为。研究利用表达UNC-103的线虫进行正向遗传学筛选,发现线虫DNA拓扑异构酶2相关蛋白PATR-1调控UNC-103通道生成。
进一步,研究探究了人源DNA拓扑异构酶2相关蛋白(PATL1和PATL2)是否调控hERG通道的功能。在人神经母细胞瘤细胞和人诱导多能干细胞衍生的心肌细胞(hiPSC-CMs)中,研究利用小干扰RNA下调PATL1和PATL2功能显著降低了内源hERG通道蛋白的表达水平和钾电流密度。此外,下调PATL1和PATL2表达还延长了hiPSC-CMs动作电位的时程,提示PATL1和PATL2可能影响心肌细胞的电生理特征。研究通过双荧光素酶报告基因检测系统分析发现,PATL1和PATL2影响hERG mRNA的合成。
一般认为,PATL1和PATL2作为脱帽激活因子促进mRNA降解以及作为翻译抑制子抑制翻译,而该研究发现人类的DNA拓扑异构酶2相关蛋白PATL1和PATL2是新的hERG通道生成调控因子,且调控hERG通道基因的转录,这揭示了其调控基因表达的新机制,扩宽了关于在转录水平调控hERG通道生成的研究。
研究工作得到科技部、中科院、国家自然基金委员会和上海市的资助,并得到脑智卓越中心分子细胞技术平台和光学成像平台的支持。
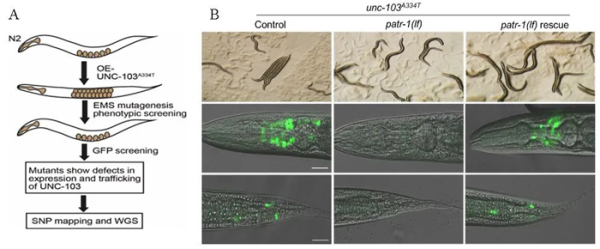
图1.A、筛选UNC-103通道生成调控基因的策略;B、线虫DNA拓扑异构酶2相关——蛋白PATR-1调控UNC-103通道生成。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


