Nat Metab | 艾玎/朱毅/孙金鹏发现多不饱和脂肪酸对动脉粥样硬化保护作用的潜在机理
来源:生物探索 2024-07-01 11:49
该研究结果表明,17,18-EEQ的抗炎作用涉及激活ECs中的S1PR1-Gq-Ca2+ -eNOS轴,为动脉粥样硬化提供了潜在的治疗靶点。
天津医科大学艾玎、朱毅及山东大学孙金鹏共同通讯在Nature Metabolism 在线发表题为“The sphingosine-1-phosphate receptor 1 mediates the atheroprotective effect of eicosapentaenoic acid”的研究论文,该研究发现内皮细胞(ECs)中的17,18-环氧二碳四烯酸(17,18-EEQ)及其受体鞘氨醇-1-磷酸受体1 (S1PR1)可以抑制振荡剪切应力或肿瘤坏死因子-α诱导的内皮细胞活化。值得注意的是,在内皮细胞S1PR1缺乏的雄性小鼠中,17,18-EEQ和纯化EPA的动脉粥样硬化保护作用被绕过。
在机制上,17,18-EEQ的抗炎作用依赖于钙释放介导的内皮型一氧化氮合酶(eNOS)的激活,而eNOS的激活在抑制S1PR1或Gq信号传导时被消除。此外,17,18-EEQ通过与Lys34Nter的极性相互作用变构调节S1PR1的构象。最后,含有高纯度和稳定的EPA乙酯的处方药Vascepa通过17,18-EEQ-S1PR1途径在雄性和雌性小鼠中发挥心血管保护作用。总之,该研究结果表明,17,18-EEQ的抗炎作用涉及激活ECs中的S1PR1-Gq-Ca2+ -eNOS轴,为动脉粥样硬化提供了潜在的治疗靶点。

心血管疾病仍然是一个主要的全球健康问题,促使对潜在的预防和治疗战略进行广泛的研究。ω-3 PUFAs,特别是EPA和二十二碳六烯酸(DHA),因其潜在的心血管益处而受到相当多的关注。食用深海鱼或鱼油,已知是ω-3 PUFAs的丰富来源,与降低心血管终点事件的发生率有很强的相关性。然而,研究ω-3 PUFAs对心血管结果影响的临床试验结果相互矛盾,导致其真正功效的不确定性。ω-3 PUFAs发挥其心血管作用的潜在机制尚未完全解决。
G蛋白偶联受体(GPCRs)是人体组织中表达的最大的膜受体家族,通过检测细胞外配体和启动细胞内信号级联反应,在调节广泛的生理反应中发挥关键作用。近年来,作为人类疾病的潜在治疗靶点,GPCRs引起了越来越多的关注。值得注意的是,一个显著的发现是通过特定的脂肪酸代谢物识别和激活许多GPCRs,从而通过第二信使或阻滞蛋白介导的机制调节细胞内信号通路。例如,包括GPR41、GPR43、GPR84、GPR40和GPR120在内的几种GPCRs已显示出对脂肪酸刺激的反应性。此外,ARA衍生的代谢物,如前列腺素,通过环加氧酶途径产生,导致多种脂质介质的产生,包括PGE2、PGF2α和PGD2。这些代谢物依次选择性地激活特定受体,如EP、FP和PGD受体。然而,EPA和DHA及其各自的代谢物通过与细胞特异性GPCRs结合而作为信号分子发挥作用的程度仍有待充分阐明。
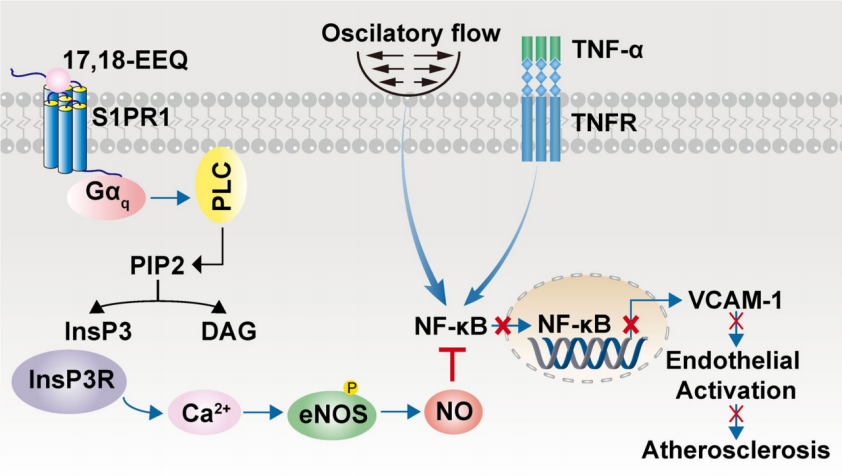
17,18-EEQ介导的抗炎作用机制(Credit: Nature Metabolism)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


