Keytruda在华第六项上市申请拟纳入优先审评
来源:医药观澜 2020-07-28 12:31
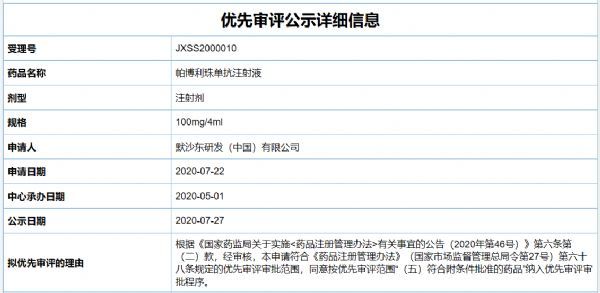
中国国家药监局药品审评中心(CDE)最新公示,默沙东(MSD)开发的重磅PD-1抑制剂Keytruda(帕博利珠单抗,pembrolizumab)一项新药上市申请拟纳入优先审评,纳入理由为符合附条件批准。根据CDE官网,这是Keytruda在中国提交的第六项上市申请,从该药正在中国开展的临床试验进展和行业动态来看,适应症可能为晚期肝细胞癌(HCC
中国国家药监局药品审评中心(CDE)最新公示,默沙东(MSD)开发的重磅PD-1抑制剂Keytruda(帕博利珠单抗,pembrolizumab)一项新药上市申请拟纳入优先审评,纳入理由为符合附条件批准。根据CDE官网,这是Keytruda在中国提交的第六项上市申请,从该药正在中国开展的临床试验进展和行业动态来看,适应症可能为晚期肝细胞癌(HCC)一线治疗。此前,它已在中国获批5项适应症,针对黑色素瘤、非小细胞肺癌(NSCLC)等。
自2018年7月首次在中国获批上市以来,截至目前Keytruda共计在中国获批5项适应症。分别是:一线治疗转移性黑色素瘤;一线治疗EGFR阴性和ALK阴性的转移性非鳞状NSCLC;一线治疗PD-L1表达阳性且无特定基因突变的局部晚期或转移性NSCLC;一线治疗转移性鳞状NSCLC;以及可能为二线治疗食管癌的第5项适应症。
根据药物临床试验登记与信息公示平台,Keytruda共计在中国登记开展了31项临床试验,大多数为国际多中心临床研究,且试验阶段为3期(27项)。除了已获批的适应症外,进展至3期的临床研究,针对适应症领域有HCC、胃癌、乳腺癌、胃食管交界处腺癌、宫颈癌、前列腺癌、尿路上皮癌、胆管癌、子宫内膜癌等。其中进展较快的有Keytruda联合仑伐替尼或单药一线治疗晚期HCC,以及联合化疗一线治疗晚期食管癌。
此次Keytruda新上市申请拟纳入优先审评,适应症可能为一线治疗晚期肝细胞癌。根据近日中国临床肿瘤学会(CSCO)发布的2020年版《原发性肝癌诊疗指南》,Keytruda联合口服多受体酪氨酸激酶抑制剂仑伐替尼获得了晚期HCC一线治疗Ⅲ级专家推荐(2B类证据)。
此前,该联合疗法已在一项名为KEYNOTE-524/study116的1b期试验中获得积极结果,对于未接受系统治疗的不可切除HCC患者达到具有临床意义的总缓解率,组合疗法达到36%的ORR,中位DOR达到12.6个月。
目前,Keytruda已经在全球多个多家和地区获批,适应症多达十余个癌种。它还在美国获得两项“不限癌种”适应症,分别用于治疗MSI-H或dMMR实体瘤,及用于单药治疗肿瘤突变负荷高(TMB-H)且既往治疗后疾病进展的无法切除或转移性实体瘤患者。
从Keytruda正在中国申报和开展的临床试验来看,该产品还将扩展更多适应症,甚至有望为中国患者带来“不限癌种”创新疗法。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。