《自然》子刊:终于实锤了!中国科学家证实,肠道菌群失衡促肝癌,肺炎克雷伯菌是肝癌的致癌菌
来源:网络 2025-01-11 10:10
这项研究成果证实,肝癌相关的肠道菌群失调与肝癌的发生有因果关系,且肺炎克雷伯菌是肝癌的致癌病原体。
大约6年前,美国科学家在顶级期刊《细胞》上,发表了一项出人意料的研究成果。
他们发现,给那些肠道菌群已经失衡的小鼠喂可溶性膳食纤维菊粉、果胶或低聚果糖,会导致40%的小鼠出现原发性肝癌[1]。
这个研究说明,肠道菌群失衡与肝癌的发生密切相关。然而,一直以来,对于肠道微生物是否直接促进肝癌的发生或发展,目前仍未可知。
近日,由香港中文大学于君团队在著名期刊《自然·微生物学》上发表一篇重要论文[1]。她们基于肝癌患者粪便样本和小鼠模型发现,肝癌患者的肠道微生物确实失衡,在将肝癌患者的肠菌移植给小鼠后,会导致小鼠的肠道屏障受损和活菌进入肝脏,进而促进肝癌的发生发展。
更重要的是,她们还证实,肠道中的肺炎克雷伯菌(Klebsiella pneumoniae)其实是促进小鼠肝脏炎症和肝癌发生的罪魁祸首,它会进入肝脏直接与肝癌细胞相互作用,促进细胞增殖、激活促癌信号通路。简单来说,肠道中的肺炎克雷伯菌其实就是导致肝癌的病原体。

▲ 论文首页截图
为了摸清肠道菌群与肝癌之间的关系,于君团队采集了肝癌患者(HCC)、肝硬化患者(LC)和健康受试者(HD)的粪便,然后将相关肠道微生物移植给无菌或无特异性病原体的小鼠。
三组受试者粪便的测序结果显示,肝癌患者粪便中微生物多样性最低,但肺炎克雷伯菌却高度富集。在移植后的小鼠肠道中,非常好的再现了不同受试者的肠道微生物特征。此外,基于无菌小鼠的诱导肝癌小鼠模型(GFD)表明,移植肝癌患者肠菌(HCC-FMT)的小鼠肿瘤直径最大、数量最多、负担最重。
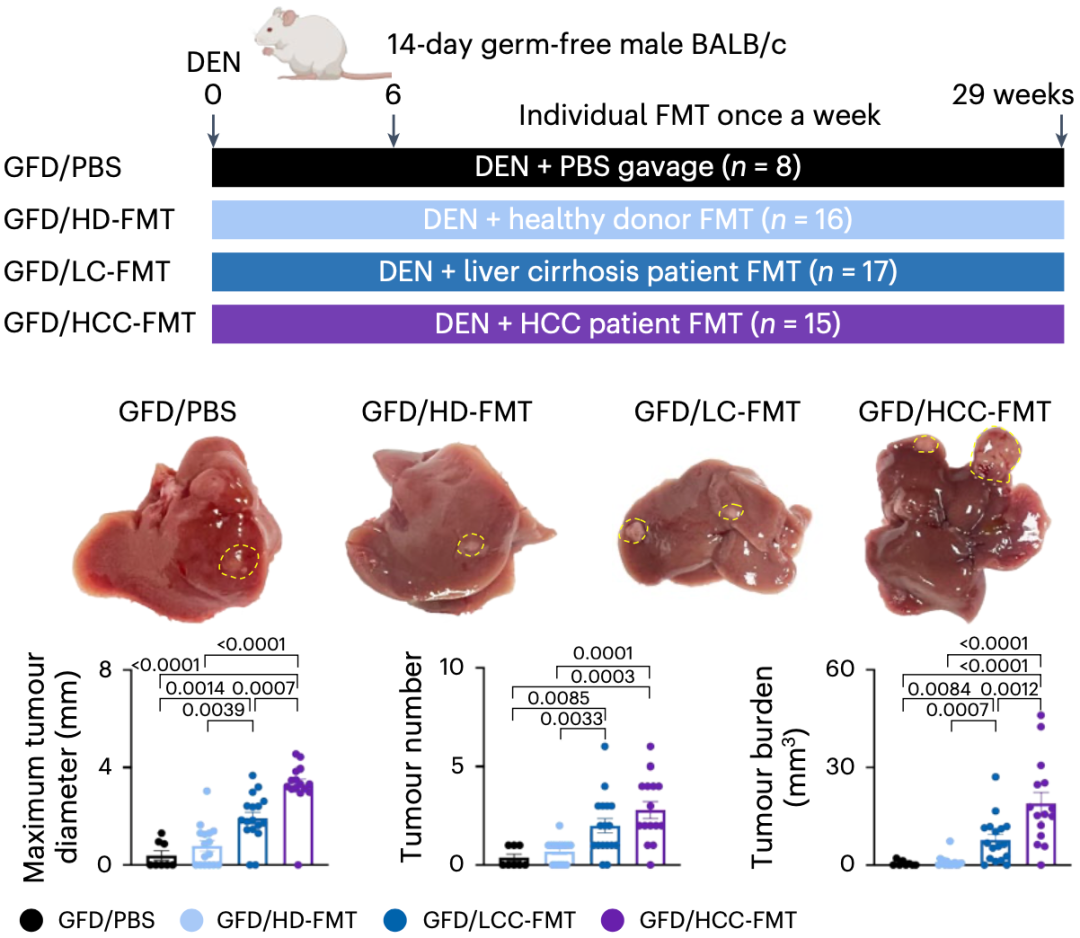
▲ 肝癌患者肠菌促肝癌
进一步的检测结果显示,移植肝癌患者的肠菌(HCC-FMT)不仅会诱导肝细胞增殖,还会诱导肝脏炎症,例如,促炎性TH1和TH17细胞增加,而抗炎性TH2细胞减少。
此外,移植肝癌患者的肠菌还会上调涉及细胞增殖、血管生成、胚胎发育、上皮间质转化和抗凋亡相关的基因,以及促炎症反应和淋巴细胞趋化相关基因表达也增加。
值得注意的是,即使不用肝癌诱导剂二乙基亚硝胺(DEN),移植肝癌患者的肠菌也能在无菌小鼠(GF)中诱发上述反应。基于此,研究人员认为,肝癌患者的肠菌可自发诱导小鼠肝脏炎症、纤维化和非典型性增生。
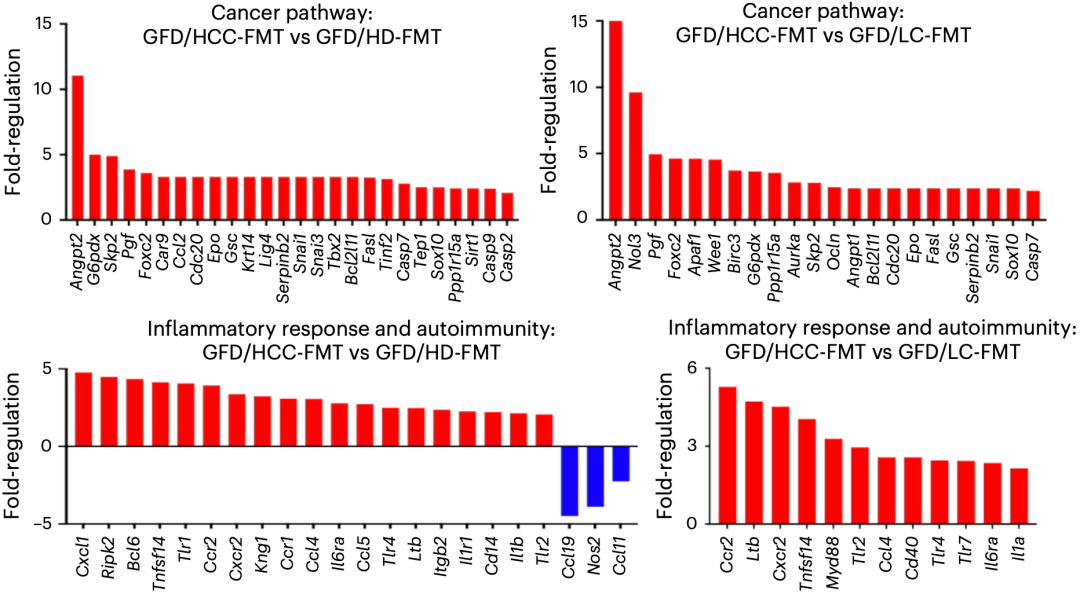
▲ 被上调的癌症和炎症通路
那肠菌是如何把“手”伸到肝脏里面去的呢?
很显然,肠道屏障受损肯定是关键。分析结果显示,无论有没有(GFD/GF)致癌物处理,移植肝癌患者肠菌的小鼠肠道通透性都会增加。电镜观察结果显示,小鼠结肠细胞间连接异常——紧密连接消失、粘连增宽。此外,结肠粘液的厚度下降,紧密连接标志物下调,细菌更多地渗入粘膜固有层和粘膜肌层。
在分析移植不同受试者粪菌的小鼠之后,于君团队发现,移植肝癌患者粪菌的小鼠肝脏中均能检测到微生物,而移植健康受试者肠菌的小鼠几乎检测不到。此外,移植肝癌患者粪菌的小鼠肝脏中,丰度最高的就是肺炎克雷伯菌,其次是粪肠球菌(Enterococcus faecalis)、奇异变形杆菌(Proteus mirabilis)、霍氏肠杆菌(Enterobacter hormaechei)和脆弱拟杆菌(Bacteroides fragilis)。
在分析肝癌患者肝脏微生物组之后,于君团队发现,肺炎克雷伯菌确实占主导地位。
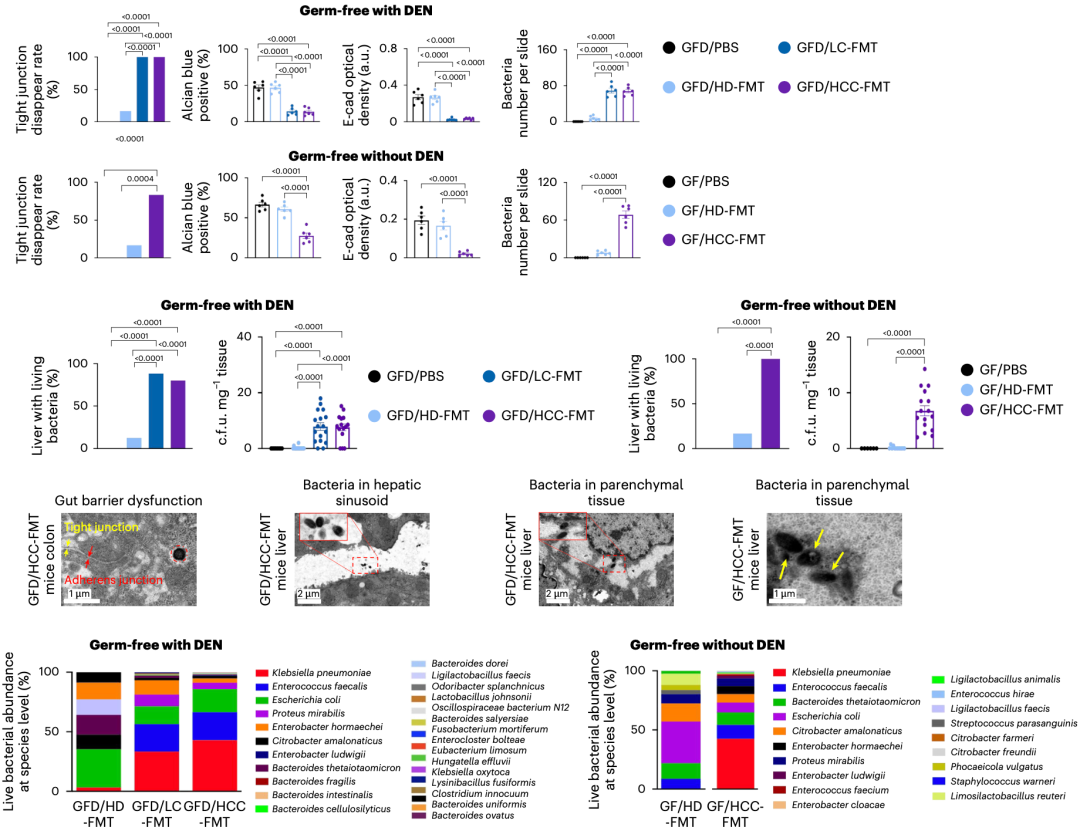
▲ 肠道屏障被破坏了、肠菌入肝了
显然,接下来的问题就是:千里迢迢由肠入肝的肺炎克雷伯菌等肠道微生物,是不是驱动肝癌的微生物。
于是,于君团队挑选了包括肺炎克雷伯菌在内的5种,在肝癌患者粪菌移植鼠肝脏中富集的革兰氏阴性菌,给无菌小鼠灌胃。结果显示,只有肺炎克雷伯菌能提高肠道通透性,并以活菌形式进入肝脏。
在分析小鼠肠道之后,她们还发现,肺炎克雷伯菌再现了移植肝癌患者肠菌对小鼠肠道的不利影响。
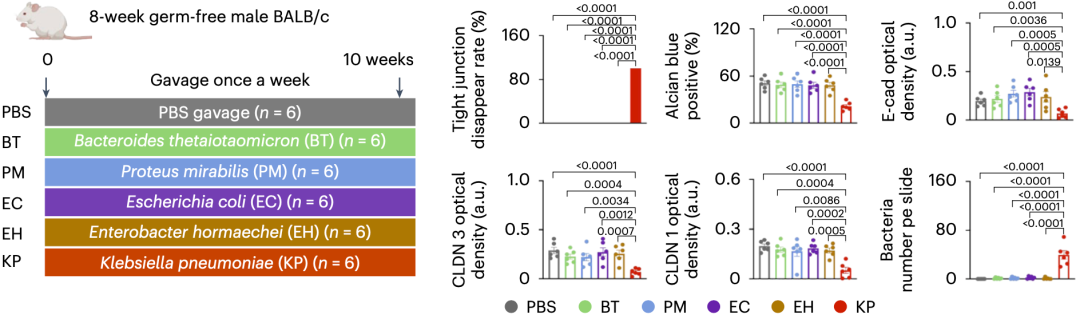
▲ 肺炎克雷伯菌再现移植肝癌患者肠菌对小鼠肠道的不利影响
至于肺炎克雷伯菌进入肝脏的方式,于君团队发现,肺炎克雷伯菌会促进肠道巨噬细胞分泌一种明胶酶,破坏肠道屏障的完整性,进而伺机逃离肠道进入肝脏。
为了验证肺炎克雷伯菌能否导致肝癌,于君团队用肺炎克雷伯菌给无菌小鼠灌胃36周(不使用致癌剂),并以大肠杆菌和PBS灌胃作为对照。她们发现,只有肺炎克雷伯菌能诱导肝细胞增殖、纤维化损伤、致癌/促炎信号传导,以及出现非典型性增生(癌前病变)。
在无特异性病原体的小鼠模型(SPF)中,肺炎克雷伯菌有同样的效果。如果同时给SPF小鼠注射肝癌诱导剂二乙基亚硝胺(DEN)的话,肺炎克雷伯菌会显著促进肿瘤的生长。
显然,肠道肺炎克雷伯菌可促进小鼠肝脏癌前病变和肝癌的发生。
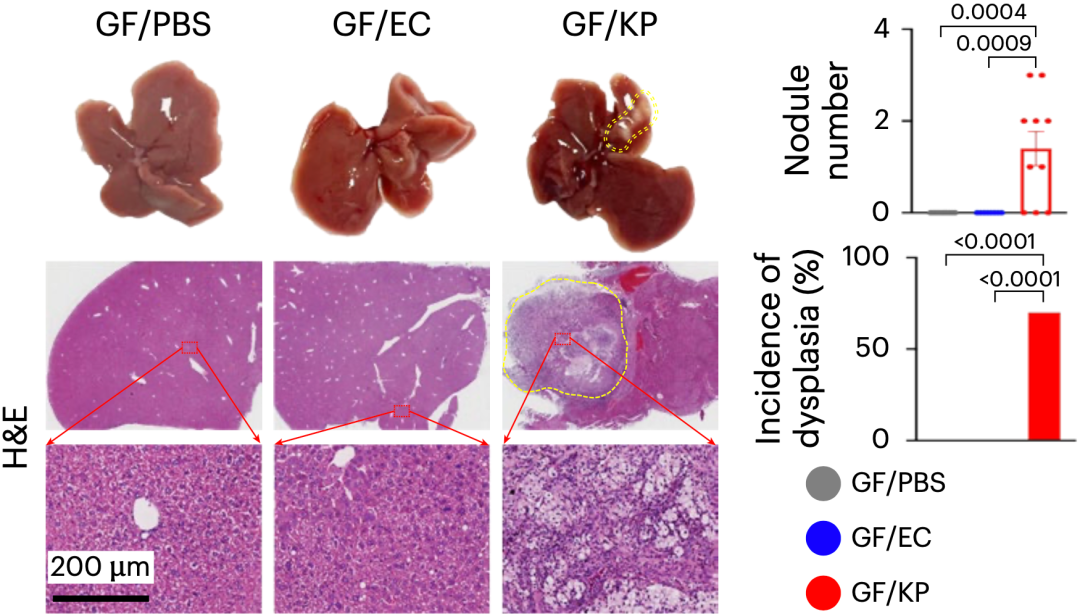
▲ 单独的肺炎克雷伯菌就可诱发非典型性增生(癌前病变)
至于肺炎克雷伯菌促肝癌的机制,于君团队发现,肺炎克雷伯菌细胞壁中的青霉素结合蛋白1B(PBP1B),可以与肝癌细胞表面的受体TLR4结合,激活TLR4下游信号通路,进而促进肿瘤的生长。而TLR4抑制剂(TLR4i)TLR4-IN-C34,可以抑制PBP1B诱导的肝癌细胞生长。
基于小鼠模型的研究还发现,TLR4抑制剂TLR4-IN-C34可以逆转肺炎克雷伯菌对DEN注射无菌小鼠肿瘤发病率、肿瘤数量和肿瘤负荷的影响。虽然TLR4-IN-C34不能恢复肠道屏障或阻止肺炎克雷伯菌进入肝脏,但它能有效抑制TLR4激活、肝细胞增殖、纤维化标志物表达,以及致癌和促炎信号传导。
总的来说,于君团队这项研究成果证实,肝癌相关的肠道菌群失调与肝癌的发生有因果关系,且肺炎克雷伯菌是肝癌的致癌病原体。这一发现让我们对肠菌失衡与肝癌的关系有了新认知,也为肝癌的防治提供了新思路。
据统计,肠道肺炎克雷伯菌在人群中的流行率约为5%,因此,对于这部分人而言,保护好自己的肠道微生态,防止肺炎克雷伯菌富集,或是预防肝癌发生发展的重要手段。
参考文献:
[1].Singh V, Yeoh BS, Chassaing B, et al. Dysregulated Microbial Fermentation of Soluble Fiber Induces Cholestatic Liver Cancer. Cell. 2018;175(3):679-694.e22. doi:10.1016/j.cell.2018.09.004
[2].Wang X, Fang Y, Liang W, et al. Gut-liver translocation of pathogen Klebsiella pneumoniae promotes hepatocellular carcinoma in mice. Nat Microbiol. Published online January 2, 2025. doi:10.1038/s41564-024-01890-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


