Nat Commun | 武汉大学李枫/张蔚/熊洁揭示聚集体的形成促进卵巢癌中ASK1/JNK信号的激活和干性维持
来源:生物世界 2024-02-20 11:58
该研究表明肿瘤细胞中的聚集体形成可以作为信号枢纽发挥作用,并且基于聚集体的治疗对于OTUD1high的卵巢癌患者具有转化潜力。
武汉大学李枫、张蔚及熊洁共同通讯在Nature Communications发表题为“Aggresome formation promotes ASK1/JNK signaling activation and stemness maintenance in ovarian cancer”的研究论文,本研究多组学筛选揭示了OTUD1蛋白在保留卵巢癌干细胞(OCSC)特性方面发挥重要作用。
从机制上讲,OTUD1蛋白水平升高导致基于OTUD1的细胞质聚集体的形成,该聚集体由位于固有无序OTUD1 N末端区域的短肽介导。此外,基于OTUD1的聚集体通过蛋白质-蛋白质相互作用募集ASK1,进而以非泛素化酶非依赖性方式稳定ASK1,并激活下游JNK信号通路以维持OCSC。值得注意的是,破坏基于OTUD1的聚集体或用ASK1/JNK抑制剂治疗,可有效降低OTUD1high卵巢癌细胞的OCSC干性(OSCS)。该研究表明肿瘤细胞中的聚集体形成可以作为信号转导枢纽,并且基于聚集体的治疗对于OTUD1high的卵巢癌患者具有转化潜力。

上皮性卵巢癌是妇科恶性肿瘤相关死亡的主要原因。高级别浆液性卵巢癌(HGSOC) 是临床上最常见的组织型,被认为起源于输卵管。尽管初始治疗方法通常有效,但大约80% 的患者会出现复发,复发性疾病的治疗方案仍然具有挑战性。卵巢癌干细胞(OCSC)的存在历来被认为在初始化疗后的致瘤性、肿瘤转移和癌症复发中起着重要作用。
消除癌症干细胞(CSC)被认为是癌症治疗的有效策略,促使了解 CSC 亚群如何在肿瘤中维持。与正常干细胞类似,肿瘤干细胞具有自我更新和分化为异质性肿瘤细胞的能力。自我更新和分化之间的平衡有助于 CSC 的丰富性。一些表面标记,如CD44, CD133, CD24, ALDH和EpCAM,已被报道可识别或分离OCSCs。此外,包括NANOG、OCT4和SOX2在内的几个转录因子被认为是细胞内的标志物。在OCSCs向非致瘤性细胞的转化过程中,某些基因的表达是否发生了必要的改变仍然是很大程度上未知的。鉴于卵巢CSC亚群可以通过不同的信号通路维持,因此阐明其激活的机制将提供有价值的诊断生物标志物和治疗靶点。
传统化疗和OCSC靶向治疗的结合可能是卵巢癌的一种有效且有前途的抗癌治疗方法。抗OCSC治疗的靶点是调节OSCS维持的OCSC的表面和细胞内标志物。WNT、Hedgehog、Notch、JNK和MAPK等信号通路的激活也被证明与OCSC的特性相关,靶向这些信号通路似乎是一个合适的选择。遗憾的是,不同通路抑制剂单药或联合其他抗癌药物的抗OSCS活性的临床试验迄今没有显示出令人满意的疗效。治疗效果不佳的主要原因之一是无法耐受的毒性。
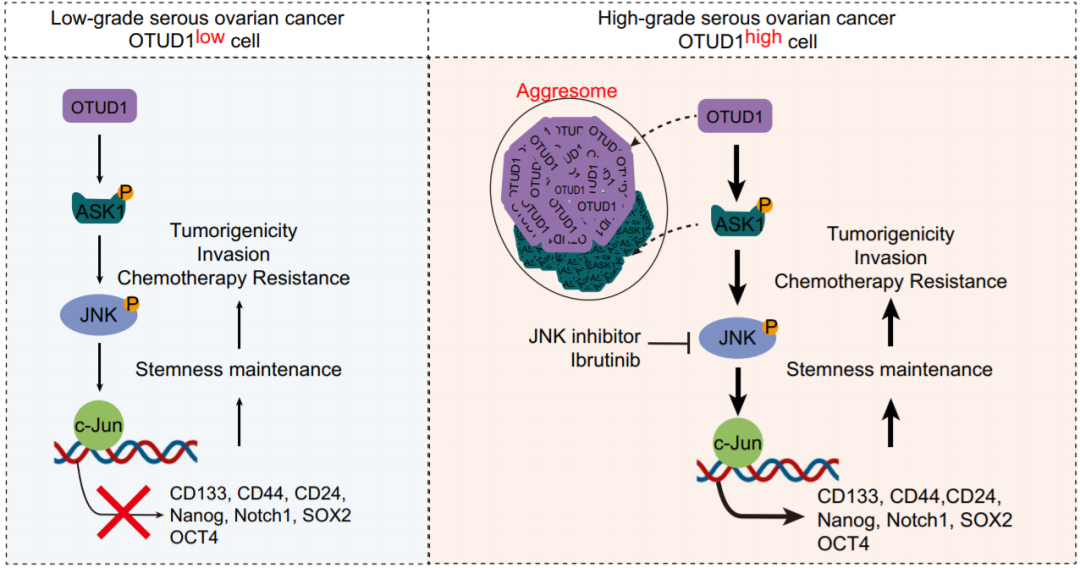
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


