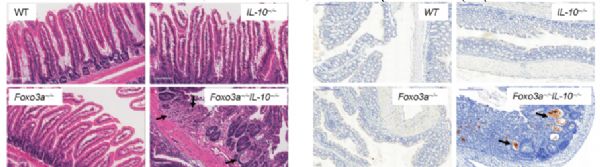
Foxo3a调节活化T细胞中过量的谷氨酰胺分解,以防止IL-10 /小鼠结肠炎模型中致命的肠道炎症
来源:本站原创 2021-10-26 12:01
与肠道炎症相关的易感等位基因突变,如克罗恩病;然而,这并不经常影响疾病的进展,表明代偿基因的存在。
与肠道炎症相关的易感等位基因突变,如克罗恩病;然而,这并不经常影响疾病的进展,表明代偿基因的存在。作者发现,在il -10缺陷小鼠中Foxo3a表达的减少导致自发性和侵袭性克罗恩病,外显率为100%,这种疾病通过骨髓细胞、T细胞的缺失和mTORC1的抑制得以挽救。在Foxo3a / IL-10 /小鼠中,肠道中髓系细胞死亡较差,导致肠道中髓系细胞和T细胞积累增加。
髓系细胞表达高水平的炎症细胞因子,调节性T细胞尽管数量增加,但功能不全。Foxo3a信号抑制谷氨酰胺酶(GLS/GLS2)的转录,以防止被激活的T细胞过度消耗谷氨酰胺,并防止其转化为谷氨酸,促进TCA循环和mTORC1激活。最后,作者发现Foxo3a限制了il -10缺陷小鼠结肠原性微生物的丰度。因此,Foxo3a通过抑制激活的T细胞中的谷氨酰胺分解,介导了一个关键的检查点,以防止暴发性肠道炎症疾病的发展。
图片来源:https://doi.org/10.1038/s41418-021-00876-y
免疫细胞在不同的解剖区介导对病原体的监视。由于肠道是容纳大量微生物的最重要的粘膜环境之一,了解肠道中调节免疫反应的机制非常重要。免疫反应是由toll样受体(TLR)参与引起的,它导致转录因子(如NF-κ b)的激活和促炎因子(如TNFα)和抗炎因子(如IL-10)的表达。IL-10抑制促炎细胞因子的转录,从而抑制组织毒性、伤口愈合和组织修复。
FOXO (Forkhead box O)转录因子促进调控细胞存活、分裂和能量利用的基因的表达。在哺乳动物中,有四个独立的Foxo基因(Foxo1、Foxo3、Foxo4和Foxo6),它们具有独特和/或冗余的功能。在免疫系统中,Foxo1在T细胞反应和调节性T细胞的发育中起主导作用,而Foxo3a则有多余的作用。Foxo3a最初被认为是一种肿瘤抑制因子,但它似乎也可以调节炎症。关于Foxo3a调节免疫反应的分子机制的报道一直不一致。
foxo3a缺陷小鼠的获得性免疫反应已被证明是适度调节的,对病毒或细菌负荷没有影响。与Foxo3a相比,IL-10是一种抗炎细胞因子,由髓系细胞和T细胞表达,抑制炎症反应。IL-10的缺乏已被证明会导致自发的肠道炎症,这是由调节性T细胞功能低下引起的。细胞代谢的调节已被证明在炎症反应中发挥重要作用。大多数关于Foxo3a信号的研究都来自于内皮细胞、癌症细胞或神经元细胞,在这些细胞中Foxo3a被证明可以调节新陈代谢。有趣的是,IL-10最近被证明通过抑制mTORC1信号调节代谢。
Foxo3a信号已被证明负调控IL-10的表达。由于 IL-10 信号传导受损已被证明会促进对克罗恩病的易感性,并且某些 IL-10 缺陷小鼠品系会发生肠道炎症,因此作者生成了具有 IL-10 和 Foxo3a 双重缺陷的小鼠。作者报道了Foxo3a信号抑制髓系细胞和T细胞的代谢,这维持了调节性T细胞的功能,阻止了结肠原菌群的积累和Il-10 /宿主肠道炎症的发展。
FOXO3a对IL-10基因缺陷小鼠结肠炎的预防作用
图片来源:https://doi.org/10.1038/s41418-021-00876-y
总的来说,作者的研究结果表明,Foxo3a限制il -10缺陷宿主中结肠原性微生物的丰度,抑制谷氨酰胺水解和mTORC1激活,从而调节髓系细胞的激活,防止其损害调节性T细胞的功能。这阻止了Th17细胞的明显激活和肠道炎症疾病的发展。(生物谷
Bioon.com)
参考文献
Stephanie Hajjar et al. Foxo3a tempers
excessive glutaminolysis in activated T cells to prevent fatal gut inflammation
in the murine IL-10−/− model of colitis. Cell Death Differ 2021 Sep 29. doi: 10.1038/s41418-021-00876-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。