刘如谦通过先导编辑人类造血干细胞,挽救镰状细胞病小鼠
来源:生物世界 2023-04-20 18:53
该研究在人类造血干细胞中建立了一个治疗性先导编辑早期案例,并证明了一次性治疗自体镰状细胞病的潜在策略,使用先导编辑技术,可以直接将突变HBB基因纠正回野生型HBB基因,而且不产生DNA双链断裂(DSB
镰状细胞病(SCD)是一种常染色体隐性遗传疾病,是由表达β-珠蛋白的HBB基因的 A·T-to-T·A 点突变引起,突变导致β-珠蛋白上第六位原本的谷氨酸被替换成缬氨酸,进而导致红细胞形态异常,呈现镰刀型,因此也叫做镰刀状细胞贫血症。
镰状细胞病患者会出现包括贫血、严重急性/慢性疼痛、免疫缺陷、多器官衰竭,甚至过早死亡。异基因造血干细胞移植(骨髓移植)是目前唯一被FDA批准的治疗这种遗传疾病的方法,然而,骨髓移植费用巨大、配型极其困难,因此,绝大多数患者只能依赖频繁输血维持生命,不仅给家庭带来极大经济负担,患者的生活质量也很低。
近年来,基因编辑和基因治疗技术的崛起为彻底治愈这种严重遗传病带来了新希望。之前有临床研究通过慢病毒导入β样珠蛋白基因,或使用CRISPR-Cas9基因编辑抑制BCL11A基因,从而重新激活γ-珠蛋白表达,弥补β-珠蛋白的缺失。
但是,这两种方法都具有一定的缺陷,慢病毒载体存在插入突变风险,CRISPR-Cas9会造成DNA双链断裂,会带来片段插入、缺失、易位、染色体片段丢失、染色体碎裂、p53激活等多种潜在风险。而且这两种方法都没有消除致病性的突变β-珠蛋白,都属于“曲线救国”。


2019年10月21日,刘如谦团队在 Nature 发表论文【2】,开发了一种全新的精准基因编辑工具——先导编辑,无需依赖DNA模板便可有效实现所有12种单碱基的自由转换,而且还能有效实现多碱基的精准插入与删除。该工具“理论上可以修复75000种已知致病性人类遗传变异的89%”。

此后几年时间里,全世界各地数百个实验室纷纷证实了先导编辑的强大性,刘如谦也围绕该技术创建了新公司 Prime Medicine,该公司于2022年10月在纳斯达克上市。
先导编辑(Prime Editor,PE)系统由两部分组成:一个含有DNA切口酶(nickase)和工程逆转录酶(RT)的融合蛋白;另一个是PE引导RNA——pegRNA。pegRNA包含一个指定目标位点的间隔体(spacer),一个单向导RNA(sgRNA)支架和一个编码所需编辑的3'端扩展。
该3'端扩展包含一个引物结合位点(PBS),它是互补的一部分DNA原间隔和一个RT模板,编码所需的编辑和下游基因组序列。PE系统与靶位点结合后,将含有PAM序列的DNA链切出,切出的DNA链碱基对与pegRNA中的PBS结合,从而将反转录的编辑序列直接引到靶DNA位点。新合成的编辑DNA的3'端随后通过细胞DNA修复途径分解,最终在目标位置进行所需的编辑。
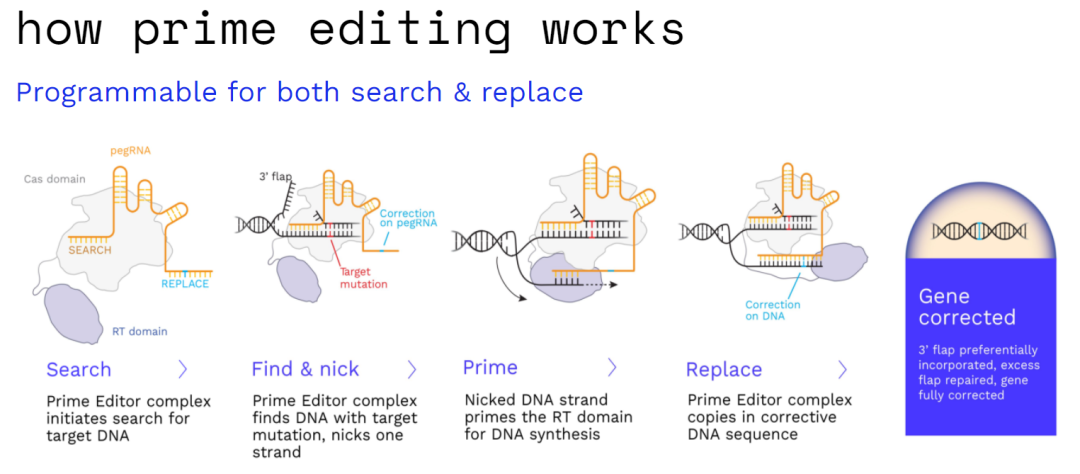
先导系统工作示意图
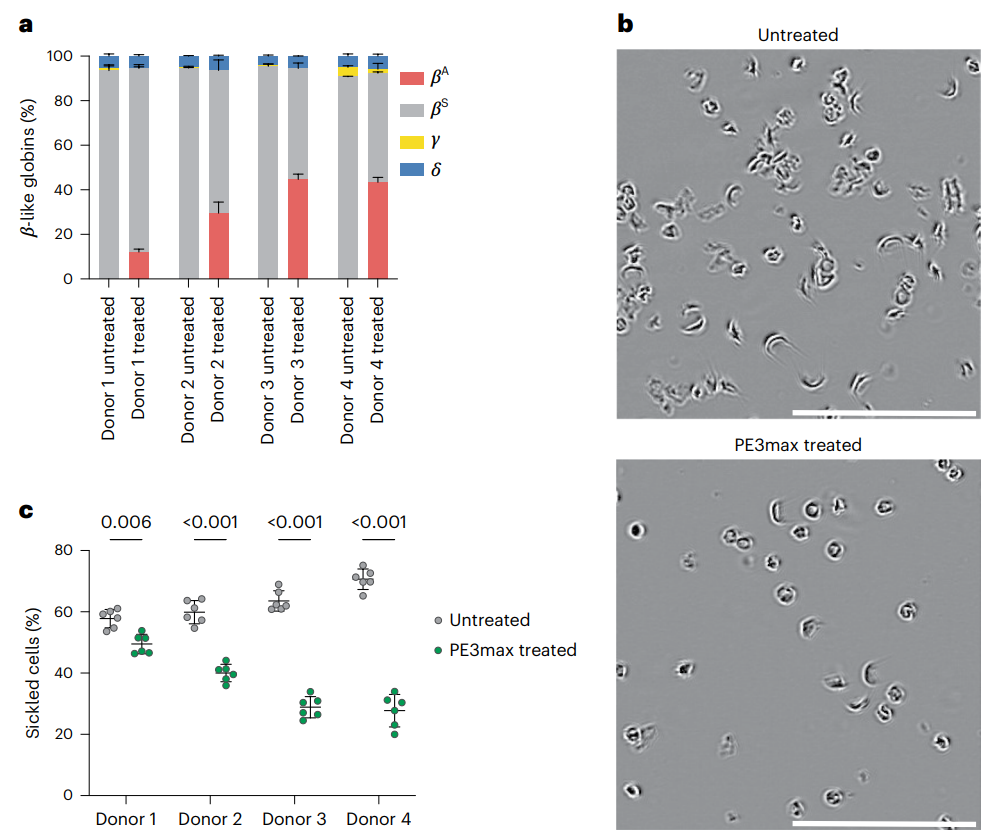
在这项研究中,研究团队对镰状细胞病患者的造血干/祖细胞(HSPC)进行先导编辑,已修复其HBB基因的点突变,编辑效率为15%-41%。
然后,研究团队将这些经过先导编辑修复的HSPC移植到免疫缺陷小鼠体内,移植后17周,这些细胞仍保持了编辑后恢复的野生型HBB基因水平,并显示出与来自健康供体的未编辑的HSPC相似的植入频率、造血分化和谱系成熟。
从4名镰状细胞病患者供体移植经过先导编辑的HSPC后17周,平均42%的人幼红细胞和网织红细胞表达野生型HBB基因,超过了预期的治疗获益水平。这表明HSPC在超过估计治疗阈值的水平上进行了有效编辑。
在低氧条件下培养时,先导编辑过的HSPC也显示出镰刀状表型的显著减少。HSPC来源的红细胞携带较少的镰状血红蛋白,野生型HBB基因来源的成人血红蛋白含量为正常水平的28%-43%,并抵抗缺氧诱导的镰状血红蛋白。通过无偏倚全基因组分析,这些先导编辑导致了最低水平的脱靶编辑,这表明了该策略的高度特异性。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


