FTO在溃疡性结肠炎中起重要作用
来源:生物探索 2023-10-11 14:22
该研究检测了m6 A修饰在UC患者中的参与,并发现了FTO的保护作用,这对UC具有重要的生物学、机制和临床意义。作者研究了FTO介导的m6 A修饰在表观遗传稳定CerS6(一种参与鞘脂代谢的必需酶)中
上海交通大学洪洁、陈豪燕及刘瑞欣共同通讯在Gut在线发表题为“Disruption of CerS6-mediated sphingolipid metabolism by FTO deficiency aggravates ulcerative colitis”的研究论文,该研究发现FTO缺乏破坏CerS6介导的鞘脂代谢可加重溃疡性结肠炎。该研究在UC患者的内部队列和外部队列中发现了FTO下调。DSS处理下,Ftoflox/ flox;Villin-cre小鼠肠道菌群失调,促炎巨噬细胞浸润增加,Th17细胞分化增强。
FTO缺乏导致编码神经酰胺合成酶基因CerS6的m6 A修饰增加,mRNA稳定性降低,导致CerS6下调,S1P在IECs中积累。随后,IECs分泌S1P触发促炎巨噬细胞分泌血清淀粉样蛋白A蛋白1/3,最终诱导Th17细胞分化。此外,通过生物信息学分析和实验验证,作者发现FTO表达较低的UC患者可能对vedolizumab治疗有更好的反应。总之,FTO下调通过降低CerS6表达促进UC,导致IECs中S1P积累增加,并通过m6A依赖机制加重结肠炎。UC患者较低的FTO表达可能会增强他们对维多单抗治疗的反应。

炎症性肠病(IBD)是指一组原因不明的慢性炎症性疾病,包括溃疡性结肠炎(UC)和克罗恩病(CD)。UC患者患结肠癌的风险更高UC的发展受个体遗传易感性、环境因素和表观遗传调控等多种因素的影响。近年来的研究强调了表观遗传调控在UC发病机制中的重要作用。
m6 A是一种广泛分布且丰富的mRNA表观遗传修饰,在热休克反应、细胞分化和RNA代谢等多种生物过程中发挥重要作用。mRNA的m6 A修饰是由甲基转移酶复合物催化的,该复合物主要由三个转录因子组成:甲基转移酶样3 (METTL3)、METTL14和Wilms ' tumor 1- associated protein (WTAP)。这种修饰被两种去甲基化酶去除:脂肪质量相关和肥胖相关蛋白(FTO)和AlkB同源物5 (ALKBH5)。各种研究表明,m6 A修饰参与UC的发病机制。具体来说,敲除T细胞中的METTL14会导致Treg细胞的失调和自发性结肠炎。此外,Treg细胞中Foxp3介导的METTL3缺失增加了Th1和Th17的应答然而,其他m6 A修饰成员在UC进展中的作用尚不清楚。
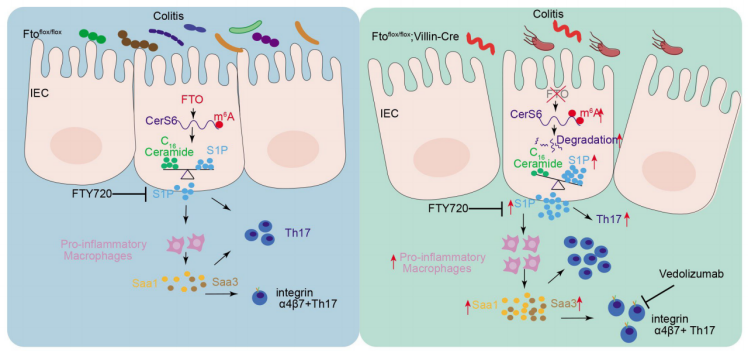
机理模式图(图源自Gut )
神经酰胺合成酶6 (CerS6)在肠道和免疫系统中高度表达,是一种优先生成C16 -神经酰胺的酶不同疾病模型的CerS6缺陷小鼠表现出不同的病理形态。一方面,缺乏CerS6会加重小鼠实验性自身免疫性脑脊髓炎(EAE),另一方面,缺乏CerS6会减少饮食性肥胖模型中巨噬细胞的浸润。鞘脂代谢已被证明在结肠炎中发挥作用,生物活性脂质鞘脂素-1-磷酸(S1P)正成为一种新的治疗靶点。
一般来说,S1P水平受两种酶(Sphk1和Sphk2)的活性调控,这两种酶催化鞘氨醇磷酸化,或者通过控制鞘氨醇的量来调节在神经酰胺合成酶家族(CerS1-6)中,有报道称Cers2和Cers6可调节大脑、衰老胃平滑肌细胞和葡聚糖硫酸钠(DSS)诱导的炎性结肠中的鞘氨醇水平。然而,m6 A修饰是否会影响神经酰胺和S1P的平衡尚不清楚。
该研究检测了m6 A修饰在UC患者中的参与,并发现了FTO的保护作用,这对UC具有重要的生物学、机制和临床意义。作者研究了FTO介导的m6 A修饰在表观遗传稳定CerS6(一种参与鞘脂代谢的必需酶)中的作用,强调了m6 A外转录组修饰在UC和鞘脂代谢中的关键作用。该研究对UC患者的临床管理具有实际意义,并有可能为临床试验提供新的创新方法。评估FTO表达水平和鞘脂代谢水平对于使用生物制剂和S1PR调节剂有效管理UC患者至关重要。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


