三阴性乳腺癌逃逸免疫攻击?Commun Biol揭秘OXCT1通过修饰PGK1促进糖酵解的关键机制
来源:生物谷原创 2025-07-31 09:16
本研究发现,赖氨酸甲基转移酶5A通过组蛋白甲基化促进3-氧代酸辅酶A转移酶1表达,后者经琥珀酰化修饰增强磷酸甘油酸激酶1稳定性,进而促进三阴性乳腺癌有氧糖酵解和免疫逃逸。
三阴性乳腺癌(TNBC)作为乳腺癌中恶性程度最高的亚型,是全球乳腺癌相关死亡的重要原因。其发病率不断攀升且患者总体预后较差,对有效治疗策略的需求迫在眉睫。值得关注的是,与其他乳腺癌亚型相比,TNBC的程序性死亡受体-1(PD-1)表达更高,肿瘤浸润淋巴细胞更多,且肿瘤突变负荷较高,这意味着它更可能从免疫治疗中获益。然而,由于其异质性和免疫抑制性微环境,TNBC对免疫检查点抑制剂(ICIs)存在耐药性,许多患者无法从中受益。
近年来,有氧糖酵解作为代谢重编程的主要途径之一,成为研究热点,被发现是肿瘤免疫逃逸的重要原因,这一过程也被称为Warburg效应,即肿瘤细胞在氧气充足的情况下仍依赖糖酵解获取能量和营养,并产生大量乳酸,利于其在不良微环境中生存。因此,通过抑制有氧糖酵解改善免疫逃逸,可能显著提高TNBC免疫治疗的疗效。
近期,发表于Commun Biol的研究OXCT1 promotes triple negative breast cancer immune escape via modulating succinylation modification of PGK1深入探讨了3-氧代酸辅酶A转移酶1(OXCT1)在TNBC中的作用及机制。

研究发现,OXCT1高表达会促进TNBC生长。通过TCGA数据库对186例TNBC组织样本分析,Kaplan-Meier生存分析显示OXCT1高表达组患者无复发生存期更短。TNBC肿瘤组织中OXCT1表达高于癌旁组织,且在Ⅰ-Ⅳ期均有升高。体外实验中,干扰OXCT1后,MD-MBA-231和BT549细胞的活性、集落形成能力显著降低;体内实验中,裸鼠肿瘤重量和体积明显减小,细胞增殖标志物Ki67的免疫组化染色显示OXCT1干扰抑制了体内MD-MBA-231细胞的增殖。
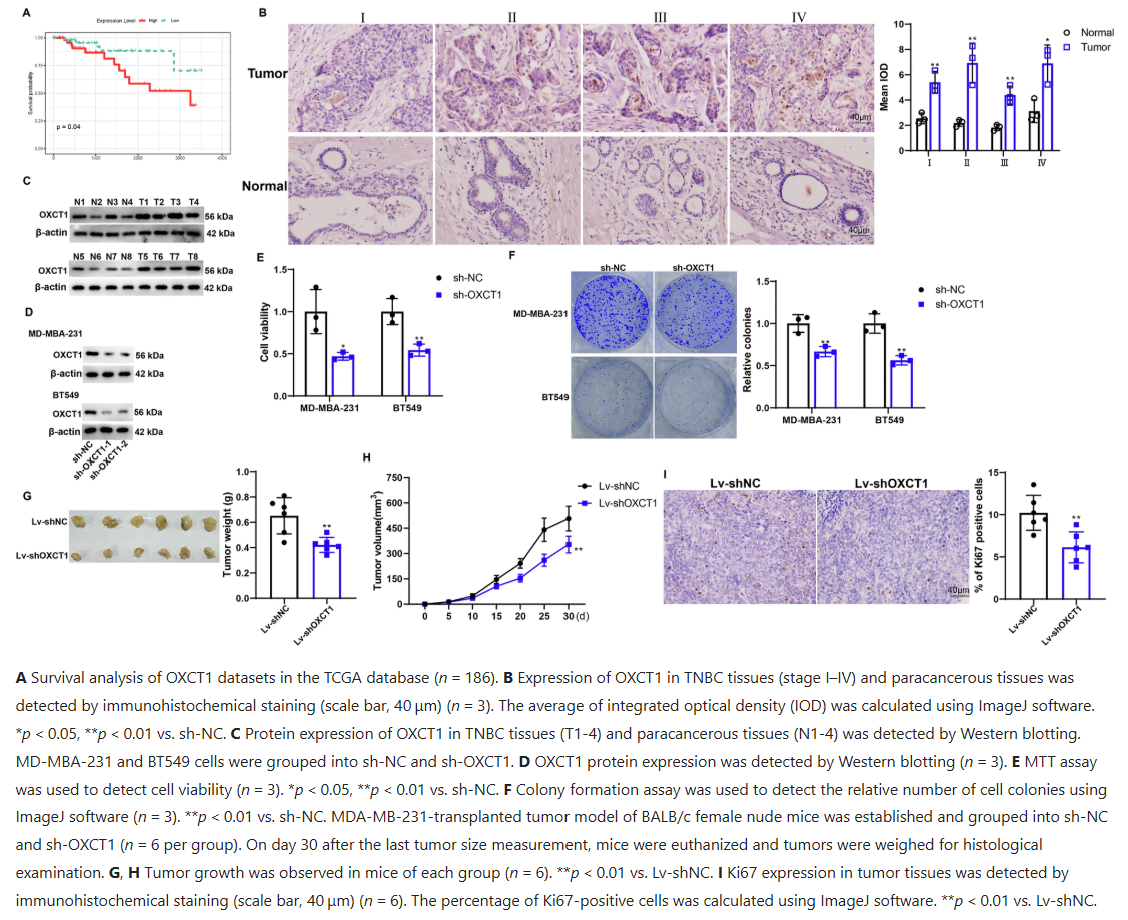
图 1:OXCT1高表达促进三阴性乳腺癌生长
OXCT1可诱导TNBC细胞的有氧糖酵解。干扰OXCT1后,TNBC细胞的基础糖酵解和糖酵解能力下降,葡萄糖消耗和乳酸分泌显著减少。过表达OXCT1会增加BT549细胞的活性和集落形成能力,而糖酵解抑制剂2-DG可逆转这一效应。此外,OXCT1与PD-L1在TNBC细胞系中的表达呈正相关,OXCT1过表达促进BT549细胞中PD-L1的表达,2-DG处理可消除该作用。在T细胞与TNBC细胞共培养实验中,OXCT1过表达使T细胞杀伤作用减弱,2-DG处理可逆转,同时OXCT1过表达对T细胞杀伤分子水平的促进作用也会被2-DG削弱。
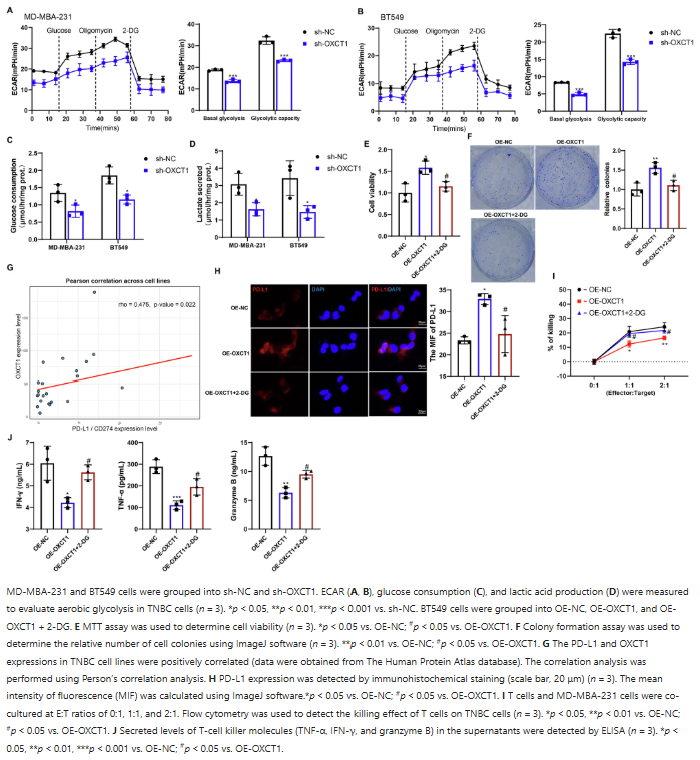
图 2:OXCT1诱导三阴性乳腺癌细胞的有氧糖酵解
在TNBC患者来源类器官(PDOs)中,干扰OXCT1同样抑制有氧糖酵解和肿瘤生长。OXCT1敲低后,PDOs的Ki67阳性细胞减少,表面积和乳酸分泌降低,与T细胞共培养时肿瘤细胞凋亡增加。
从分子机制来看,OXCT1通过介导磷酸甘油酸激酶1(PGK1)的琥珀酰化修饰增加其蛋白稳定性。过表达OXCT1会提高HK2、PGK1、PFK-1和LDHA等糖酵解关键酶的蛋白表达,其中与PGK1的相关性最显著,且OXCT1对PGK1的调控发生在翻译后水平。OXCT1过表达增加PGK1的琥珀酰化水平,随CHX处理时间延长增强PGK1蛋白稳定性,同时降低其泛素化水平。蛋白降解实验显示,OXCT1干扰后PGK1的不稳定性可被蛋白酶体抑制剂MG132挽救,而非溶酶体抑制剂CQ,表明依赖蛋白酶体途径。通过预测和突变实验发现,OXCT1介导PGK1的K146位点琥珀酰化,该位点突变会消除OXCT1对PGK1蛋白稳定性的促进作用,且PGK1野生型可增加TNBC细胞活性、克隆能力和PD-L1表达,K146R突变体无此效应。
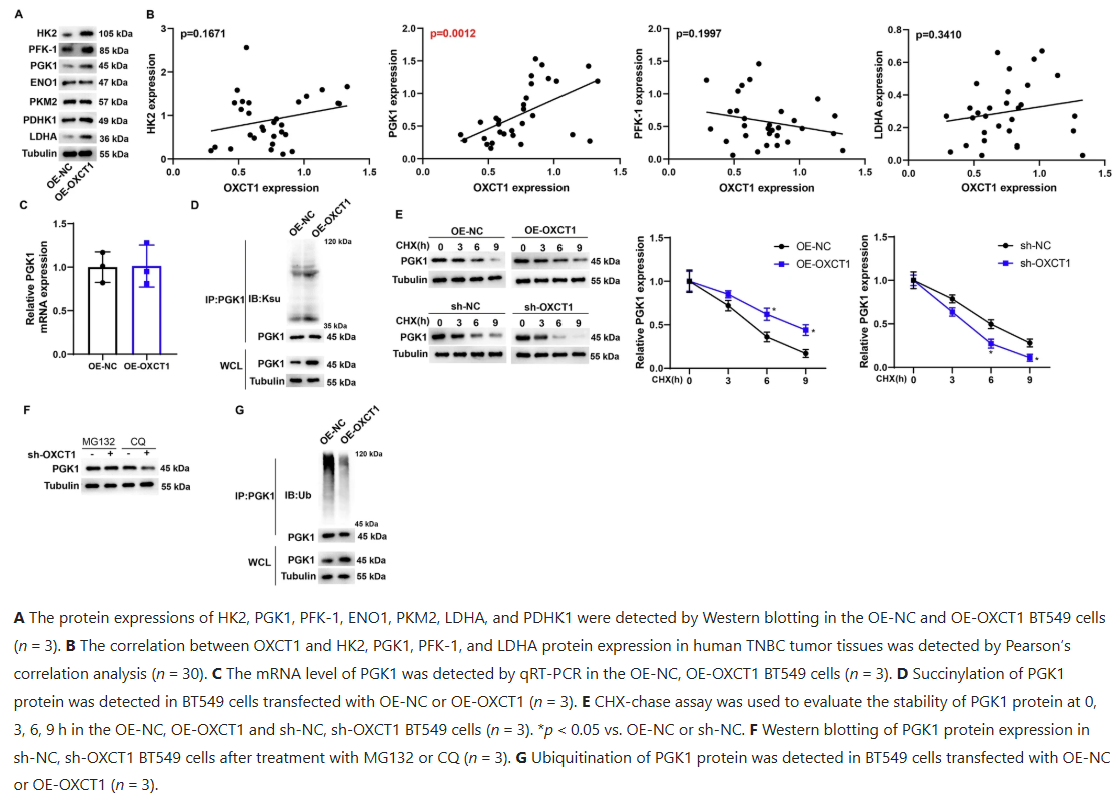
图 3:OXCT1介导磷酸甘油酸激酶1的琥珀酰化以增加其蛋白稳定性
进一步研究表明,OXCT1通过增加PGK1表达促进TNBC的有氧糖酵解。干扰PGK1可逆转OXCT1过表达对TNBC细胞活性、集落形成、PD-L1表达的促进作用,同时降低糖酵解相关指标。
此外,赖氨酸甲基转移酶5A(KMT5A)通过诱导OXCT1启动子区的H4K20me1促进OXCT1表达。TNBC组织中OXCT1启动子区H4K20me1水平升高,过表达KMT5A会增加该区域H4K20me1水平,从而上调OXCT1表达。干扰OXCT1可逆转KMT5A过表达对TNBC细胞活力、增殖和PD-L1表达的促进作用。
综上,KMT5A通过组蛋白甲基化促进OXCT1表达,OXCT1通过琥珀酰化修饰增加PGK1蛋白稳定性,进而促进TNBC的有氧糖酵解和免疫逃逸。这一研究为TNBC的治疗提供了新的靶点和思路,未来针对OXCT1或相关修饰通路的抑制剂研发,可能为改善TNBC患者的预后带来希望,让更多患者在免疫治疗中获益,减轻TNBC带来的健康威胁。(生物谷Bioon.com)
参考文献:
Zhang H, Ling M, Zhang Y, Fang Q, Wo W, Lv X. OXCT1 promotes triple negative breast cancer immune escape via modulating succinylation modification of PGK1. Commun Biol. 2025;8(1):1033. Published 2025 Jul 9. doi:10.1038/s42003-025-08433-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


