EBioMedicine:EZH2对FADS2的差异调控为卵巢癌治疗提供联合靶点,协同抑制显效
来源:生物谷原创 2025-08-25 13:13
本研究发现EZH2差异调控FADS2转录变体,联合抑制EZH2和FADS2可诱导线粒体功能障碍和能量应激,对卵巢癌有更强抗肿瘤效果,为其提供潜在治疗策略。
解析:标题包含杂志名称,点明研究核心机制(EZH2差异调控FADS2)、临床意义(提供联合靶点)及关键结果(协同抑制有效),与原文主题紧密关联,符合专业且具吸引力的要求。卵巢癌作为女性生殖系统中最具侵袭性和致命性的恶性肿瘤,其治疗一直是临床难题。多数患者确诊时已处于晚期,且对铂类化疗易产生耐药性,复发率高,预后极差。近年来,研究者们不断探索新的治疗靶点和策略,以期改善卵巢癌患者的生存状况。
近日,发表在EBioMedicine上的一项研究Differential regulation of FADS2 by EZH2 reveals a metabolic vulnerability in ovarian cancer treatment,揭示了EZH2与FADS2在卵巢癌中的调控关系及联合靶向治疗的潜力,为卵巢癌治疗带来了新的曙光。

该研究背景指出,卵巢癌具有异常脂质代谢的特征,而EZH2作为多梳抑制复合体2(PRC2)的催化亚基,通过经典的H3K27me3修饰及非经典机制发挥促肿瘤作用。尽管EZH2已被视为潜在的抗癌靶点,但其抑制剂在实体瘤中的治疗效果仍有限。
研究发现,EZH2对FADS2的转录变体具有差异化调控作用。EZH2敲除会使FADS2变体1(v1)在mRNA和蛋白水平均升高,而变体2/3(v2/3)则降低。ChIP-qPCR等实验表明,EZH2占据FADS2 v1和v2/3的启动子,但v2/3启动子处H3K27me3的富集显著低于v1启动子。此外,EZH2抑制剂会增加卵巢癌细胞中全长FADS2 v1的表达和多不饱和脂肪酸(PUFA)的丰度。
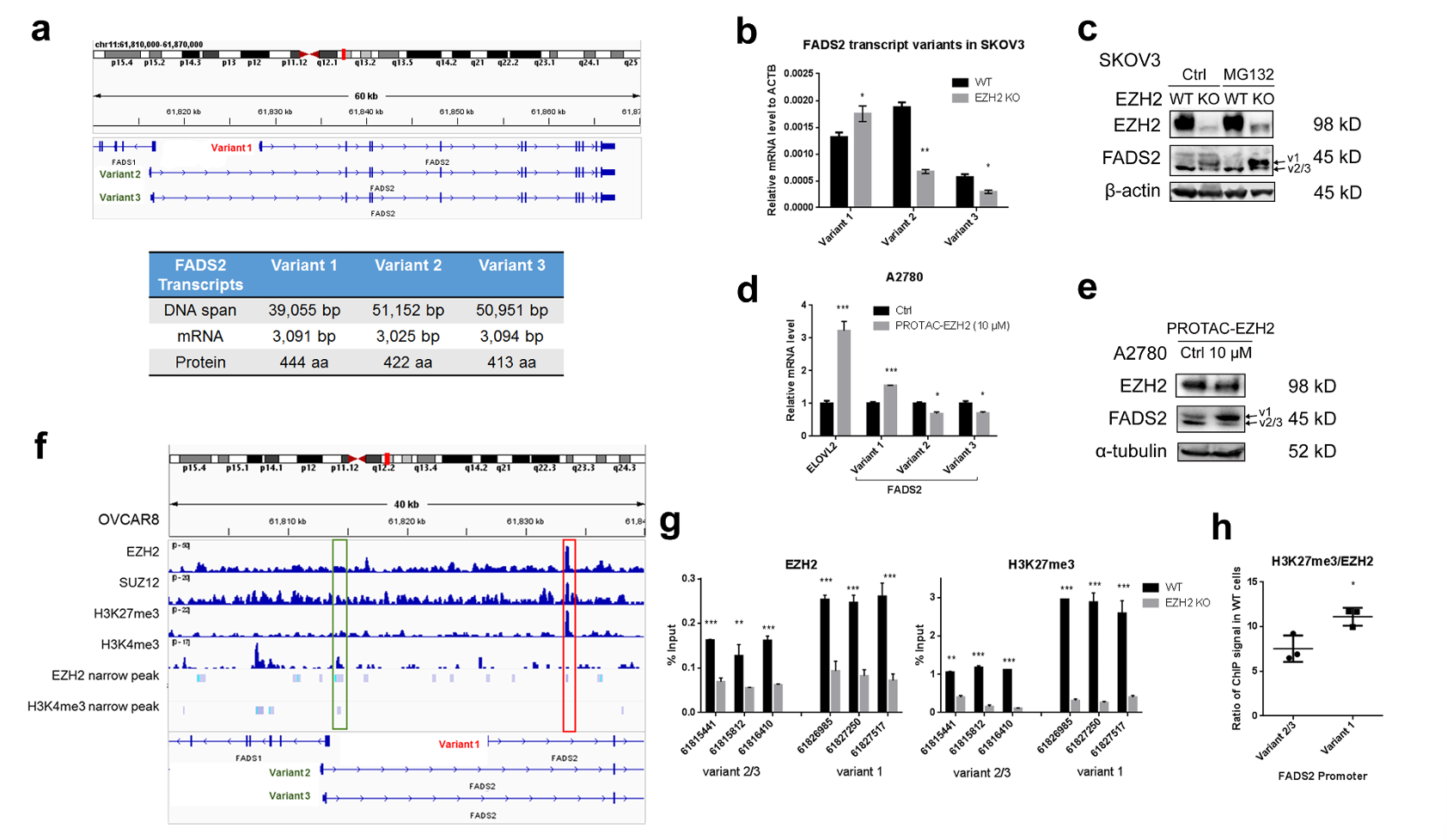
图1:EZH2对FADS2转录变体的差异化调控
临床数据显示,FADS2 v1/v2比值高与卵巢癌患者预后不良相关。通过shRNA或抑制剂靶向FADS2可降低EZH2水平,并使癌细胞对EZH2抑制剂敏感。体内外实验均证实,联合抑制EZH2和FADS2能诱导线粒体功能障碍和能量应激,协同抑制肿瘤生长。
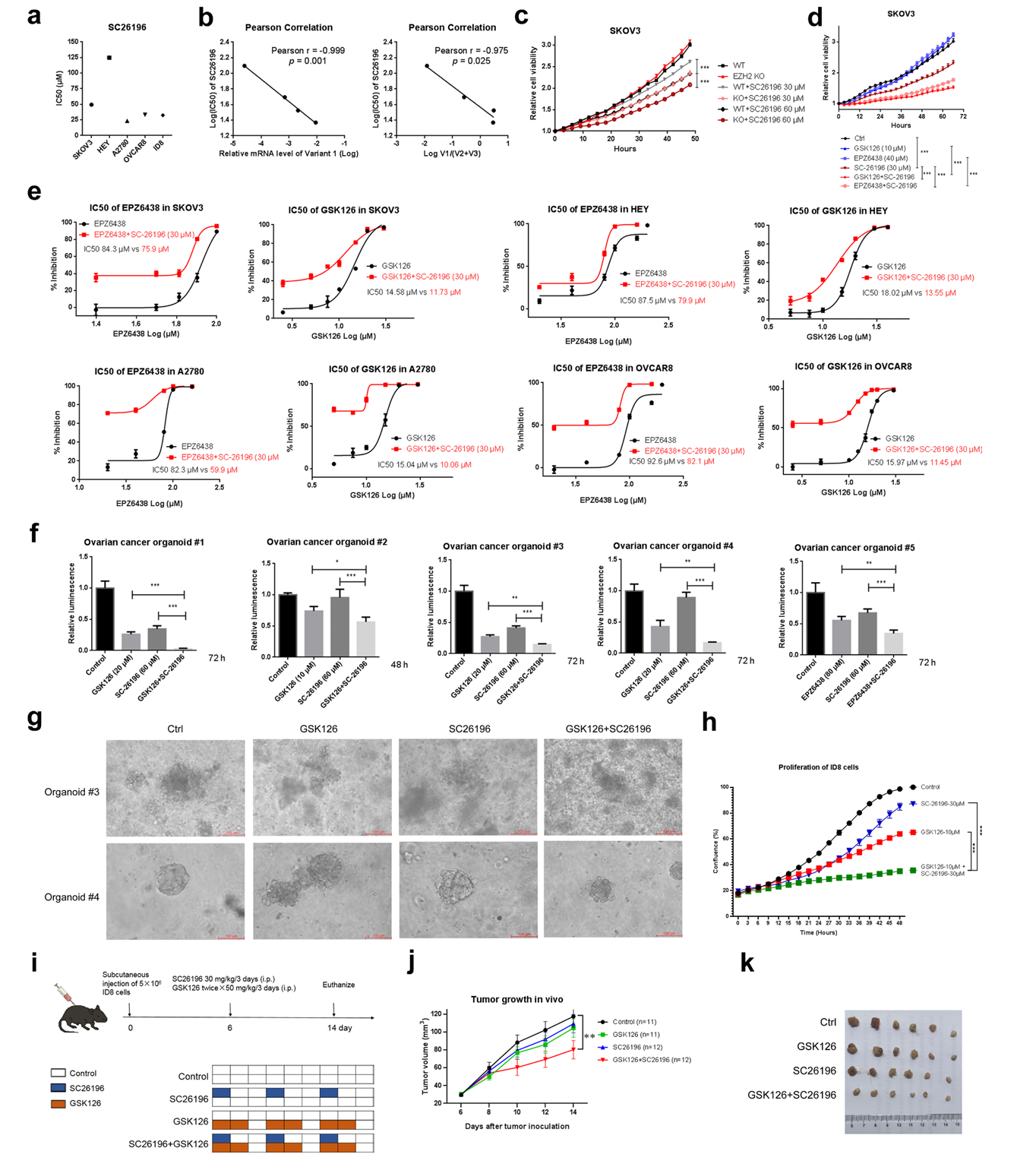
图2:联合靶向EZH2和FADS2增强对卵巢癌的抑制效果
机制研究方面,4D-DIA蛋白质组学、Seahorse实验等显示,联合治疗会抑制线粒体氧化磷酸化,减少ATP生成,激活AMPK信号通路,进而抑制mTOR介导的蛋白质合成,导致细胞周期停滞。同时,联合治疗还会下调Notch信号通路,协同抑制肿瘤进展。
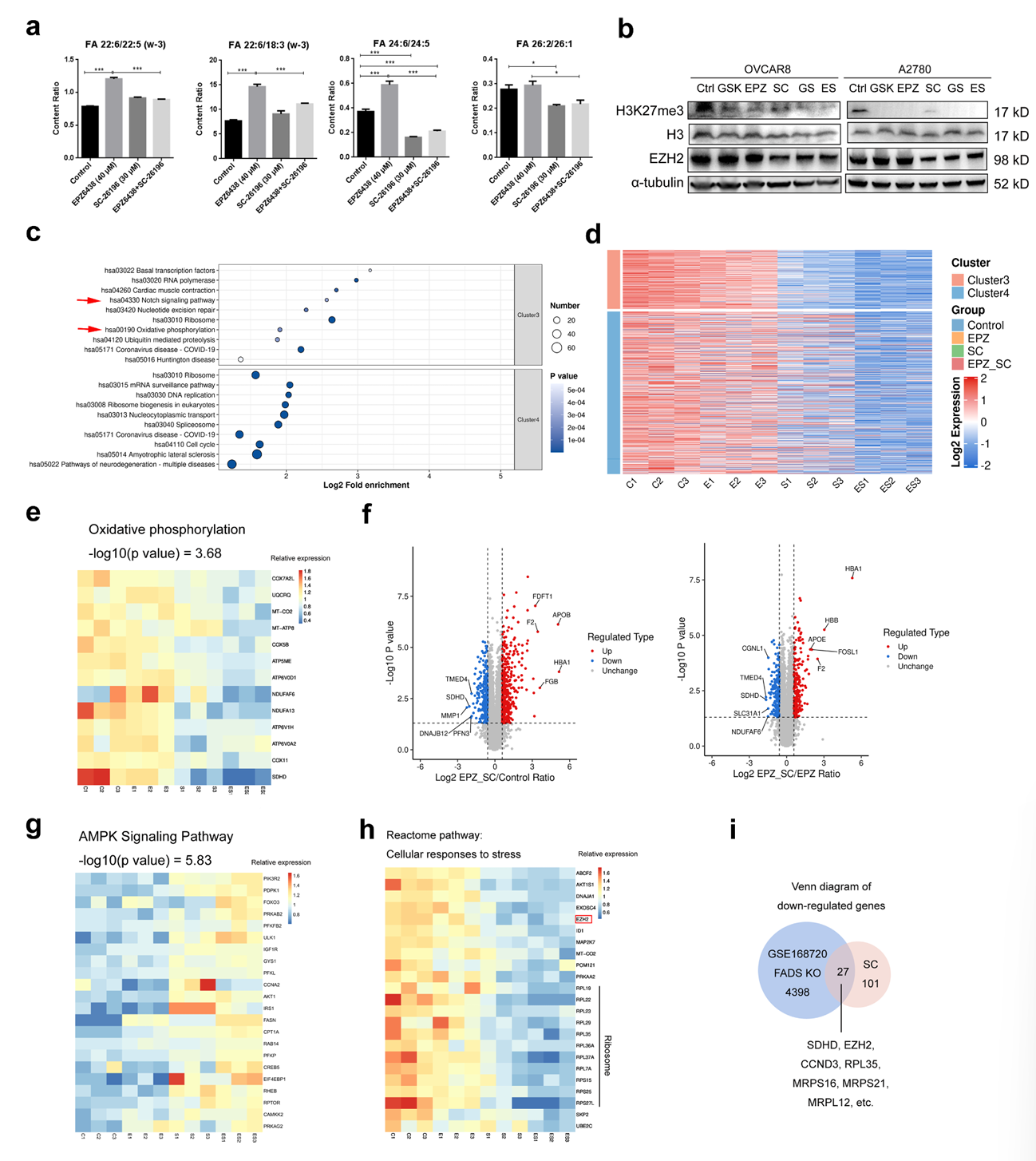
图3:EZH2和FADS2的双重抑制改变卵巢癌细胞的蛋白质组学特征
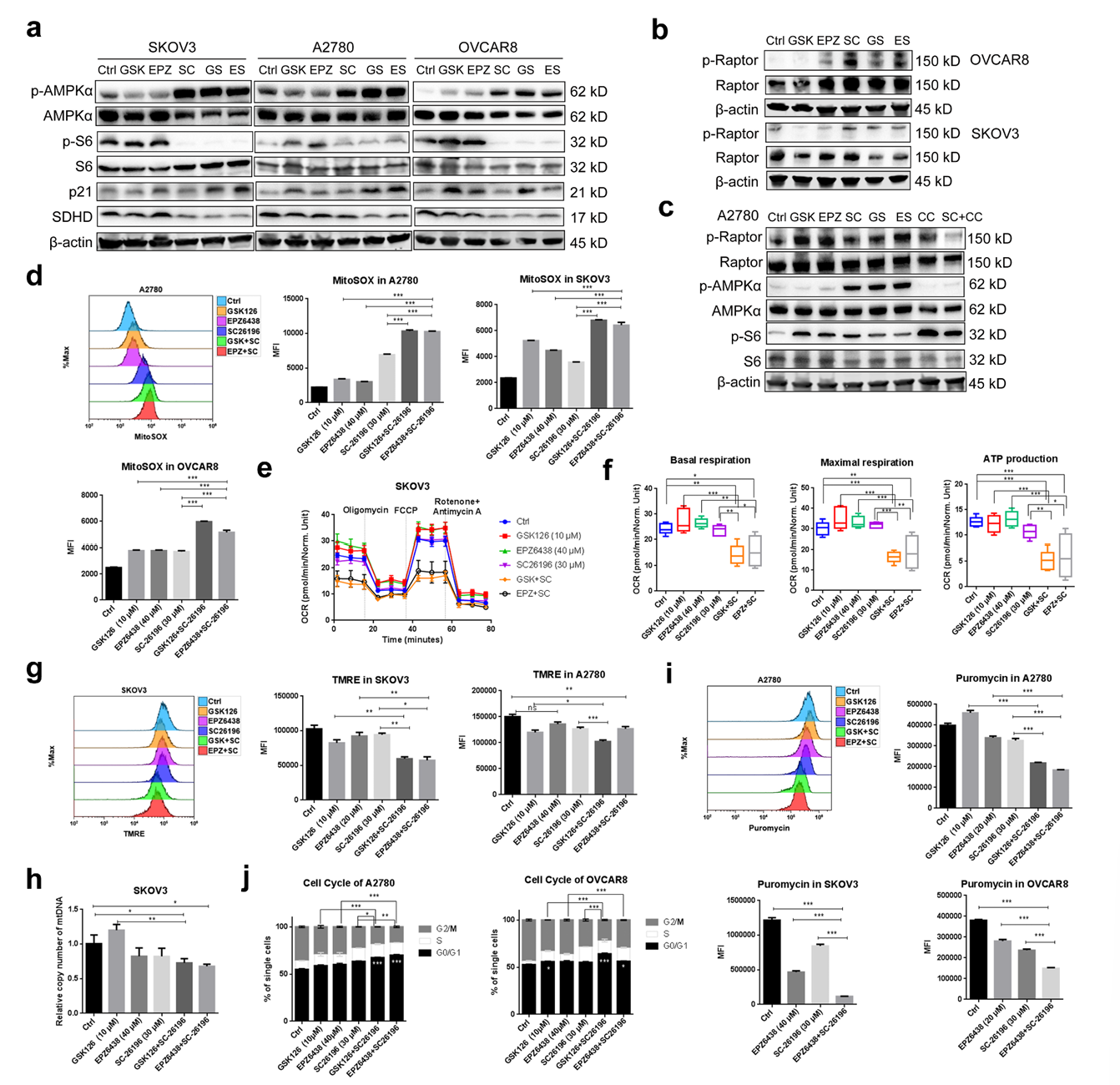
图4:联合靶向EZH2和FADS2损害卵巢癌细胞的线粒体功能
综上所述,这项研究揭示了EZH2通过差异化调控FADS2,在卵巢癌中形成代谢 vulnerability的机制。EZH2抑制会增加FADS2全长异构体的比例,而同时抑制EZH2和FADS2能通过诱导线粒体功能障碍和能量应激,产生更显著的抗肿瘤效果。这一发现不仅建立了表观遗传修饰与脂肪酸代谢之间的联系,更为卵巢癌提供了一种潜在的联合治疗策略,有望为临床治疗带来新的突破,让更多卵巢癌患者看到生存的希望。(生物谷Bioon.com)
参考文献:
Guo Z, Wang Y, Song J, et al. Differential regulation of FADS2 by EZH2 reveals a metabolic vulnerability in ovarian cancer treatment. EBioMedicine. Published online August 15, 2025. doi:10.1016/j.ebiom.2025.105879
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


