重要研究成果聚焦科学家们在肠道菌群研究领域取得的新进展!
来源:本站原创 2021-09-27 11:02
肠道菌群是一类生活在机体肠道中的微生物群落的总称,近年来越来越多的研究证据表明,肠道菌群与多种人类疾病的发生直接相关,本文中,小编对近期科学家们在肠道菌群研究领域取得的重要成果进行整理,与大家一起学习!【1】Cell Host & Microbe:肠道菌群或是结直肠癌发病风险的有效“指示器”doi:10.1016/j.chom.2021.08.013
肠道菌群是一类生活在机体肠道中的微生物群落的总称,近年来越来越多的研究证据表明,肠道菌群与多种人类疾病的发生直接相关,本文中,小编对近期科学家们在肠道菌群研究领域取得的重要成果进行整理,与大家一起学习!

肠道菌群或是结直肠癌发病风险的有效“指示器”。
图片来源:Melissa C.Kordahi,et al. Cell Host & Microbe (2021). DOI:10.1016/j.chom.2021.08.013
【1】Cell Host & Microbe:肠道菌群或是结直肠癌发病风险的有效“指示器”
doi:10.1016/j.chom.2021.08.013
结直肠癌是世界范围内人类面对的一个主要健康问题,如今越来越多的研究证据表明,肠道微生物在结直肠癌的发病过程中扮演着非常关键的角色,同时这也引起了科学家们对肠道菌群研究的极大兴趣,然而目前科学家们对与癌变前息肉相关的微生物群落的组成及其所扮演的关键角色知之甚少。近日,一篇发表在国际杂志Cell Host & Microbe上题为“Genomic and functional characterization of a mucosal symbiont involved in early-stage colorectal cancer”的研究报告中,来自华盛顿大学等机构的科学家们通过研究发现,肠道生物群中特定菌群水平的增加表明机体结肠息肉发生癌变的可能性或许更大。
文章中,研究者William DePaolo等人追踪了40名接受常规结肠镜检查并在息肉附近进行活组织检查的患者,旨在确定与没有息肉的患者相比,存在息肉的患者机体存在的细菌水平是否相对较高,所有患者的年龄均在50-75岁之间,其中60%都是女性。一种名为非产肠毒素的脆弱拟杆菌(Bacteroides fragilis)的常见细菌的水平在有息肉的患者的粘膜活检组织中明显上升了。此外,研究人员还发现了区分携带息肉和不携带息肉的患者之间的不同微生物特征,并确定了样本中脆弱拟杆菌的水平与小息肉的炎症水平之间的关联。
经过仔细检查后,研究者发现,相比无息肉的患者而言,有息肉的患者机体的脆弱拟杆菌在诱发炎症的能力上会表现出不同;研究者的整体想法是,很多人在分析晚期结直肠癌时才会想起微生物组,但很难确定是否机体的微生物组会发生改变以及何时会发生变化;因此,研究人员就需要尽可能早地分析疾病的成因,并阐明是否微生物组会将息肉推向癌症发展的方向。
【2】Science子刊:揭示高盐饮食协助肠道菌群对抗癌症机制
doi:10.1126/sciadv.abg5016
一项新的研究指出在小鼠中,高盐的饮食能抑制肿瘤的生长--但只有当肠道微生物刺激免疫细胞时,才会抑制肿瘤。这些发现提出了关于饮食和肠道微生物在人类癌症中的作用的诱人问题,并可能提出了开发新疗法的新途径。相关研究结果发表在2021年9月10日的Science Advances期刊上,论文标题为“High-salt diet mediates interplay between NK cells and gut microbiota to induce potent tumor immunity”。
美国田纳西州立大学生物学家Venkataswarup Tiriveedhi在给《科学家》网站发生的一封电子邮件中写道,虽然这项研究不是第一项将高盐饮食与缩小肿瘤联系起来的研究,但是“这些作者显示了高盐诱导肠道微生物组变化的独特机制作用,这是他们观察到的抗癌效果的核心现象”。
论文通讯作者、印度转化健康科学与技术研究所免疫学家Amit Awasthi说,他和他的同事进行了这项研究,因为以前的研究将高盐摄入与自身免疫性疾病联系在一起,这表明盐的增加会刺激免疫细胞。与此同时,众所周知,肿瘤会在免疫抑制的环境中生长。Awasthi回忆说,他和他的团队一起思考:“如果我们在小鼠的饮食中加入盐,也许[肿瘤环境中的免疫系统会被激活”,从而抑制了癌症的生长。
事实上,由比利时哈瑟尔特大学免疫学家Markus Kleinewietfeld领导的一个欧洲团队在2019年进行的一项发表在Frontiers in Immunology期刊上的研究报告称,高盐饮食抑制了小鼠体内的肿瘤生长(Frontiers in Immunology, 2019, doi:10.3389/fimmu.2019.01141)。当Awasthi和他的同事们进行类似的实验,给小鼠植入B16F10皮肤黑色素瘤细胞,然后给肿瘤移植小鼠喂食不同盐度的饮食时,他们得到了类似的结果:喂食高盐饮食的小鼠体内的肿瘤生长较慢。
【3】Cell Rep:肠道菌群或能诱导母乳中母源性抗体的分泌
doi:10.1016/j.celrep.2021.109655
通过乳汁来传递母体抗体的进化策略深刻地影响着所有新生儿的生存、终身健康和福祉,包括对人类母乳喂养成功和婴儿发育的明显影响等;尽管人们越来越认识到不同器官之间的连接影响着母亲乳汁的质量,从而有可能会为其后代提供个性化的母乳,但这些过程背后的基本依据尚没有得到解决。近日,一篇发表在国际杂志Cell Reports上题为“The gut microbiota induces Peyer's-patch-dependent secretion of maternal IgA into milk”的研究报告中,来自日本东北大学等机构的科学家们通过研究发现了机体乳腺和小肠之间的器官间网络,其或在通过母乳喂养来转移抗体上扮演着非常重要的角色。
母乳喂养能为母亲和新生儿带来一系列好处,母源性抗体能通过母乳转移到新生儿体内,从而保护机体胃肠道免受多种病原体所引发的感染;然而,母源性抗体,尤其是免疫球蛋白A(IgA)在哺乳期间在母体内产生的分子机制,研究人员依然并不清楚。如今研究人员就通过研究发现,乳腺和小肠之间所形成的器官间网络或在通过母乳喂养来转移母源性抗体上扮演着非常必要的角色。
研究者Nochi说道,本文研究或能帮助开发一种新型的免疫策略,从而增强母乳中母源性IgA的质量和水平,然而当涉及哺乳期母亲机体的抗体产生时,我们仍然缺乏一张完整的画面,这或许就阻碍了提高母乳质量的免疫学和微生物学方法的发现。此前,科学家们一直在努力充分理解哺乳期母亲的抗体产生机制,这往往阻碍了增加母乳质量的免疫学和微生物学方法的研究进展。
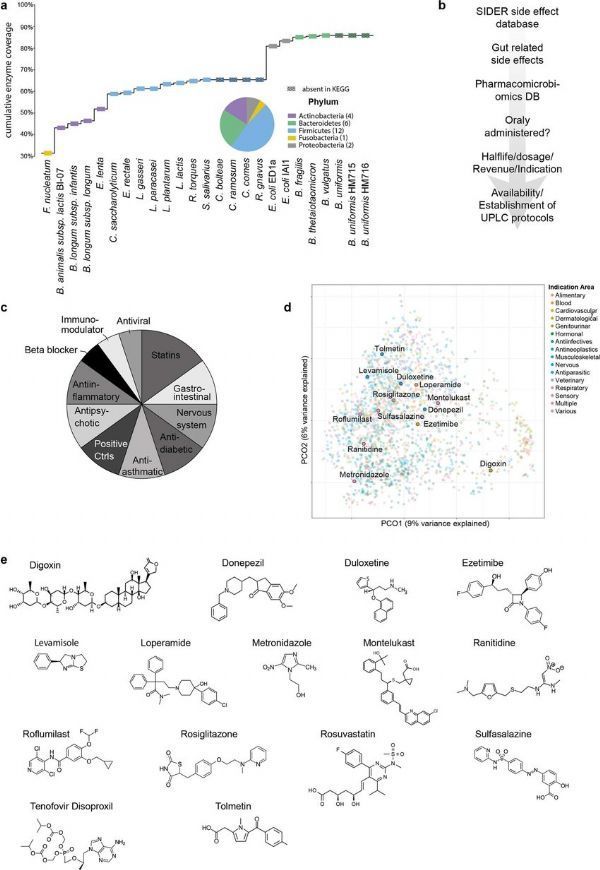
细菌和药物选择。
图片来源:Klünemann, M., et al.Nature (2021). doi:10.1038/s41586-021-03891-8
【4】Nature:重磅级发现!常见药物或能在人类机体肠道菌群中积累 或会降低药物的有效性且能改变肠道微生物组的功能!
doi:10.1038/s41586-021-03891-8
肠道中的细菌能帮助调节治疗性药物的可用性及疗效,然而研究人员最近才开始对药物和细菌之间相互作用进行系统性的分析,近日,一篇发表在国际杂志Nature上题为“Bioaccumulation of therapeutic drugs by human gut bacteria”的研究报告中,来自欧洲分子生物学实验室等机构的科学家们通过研究发现,普通的药物或能在肠道菌群中积累,从而改变细菌的功能并潜在降低药物的有效性,这种相互作用或能帮助更好地理解药物有效性和副作用的个体差异特性。
众所周知,细菌能化学性地修饰某些药物,这一过程被成为生物转化(biotransformation),这篇研究报告中,研究人员首次揭示了,特定的肠道菌群或能积累人类药物并改变细菌的类型及其活性。这或许会直接改变药物的有效性,因为药物在肠道菌群中的积累会降低机体对其可利用性,而且细菌的功能和组成的改变也与药物所产生的副作用有关。
文章中,研究人员培养了25种常见的肠道细菌,并分析了其与15种口服药物之间是如何相互作用的,选择的药物能代表一系列不同类型的药物,包括抗抑郁药物等,众所周知,这些药物对个体的影响是不同的,其会产生一定的药物副作用,比如肠道问题和体重增加等。研究人员检测了15种药物中每种药物是如何与选定的细菌相互作用的,总共进行了375次细菌-药物测试;结果发现细菌和药物之间存在70种相互作用,其中29种相互作用此前并未研究过。
尽管早期研究结果表明,细菌能化学性地修饰药物,但当科学家们进一步研究其相互作用时,他们发现,在29种新的相互作用的17种相互作用中,药物会在细菌中积累而不被修饰;让研究人员惊讶的时,目前他们所观察到的细菌和药物之间大部分相互作用是药物在细菌中的积累,因为截止到目前为止,生物转化被认为是细菌影响药物可用性的主要方式。这很有可能是个体之间的差异,其取决于个体机体肠道微生物的组成,研究人员甚至能在同一种类细菌的不同菌株之间观察到差异。
【5】Cell Host & Microbe:肠道菌群或会影响早产儿的大脑发育
doi:10.1016/j.chom.2021.08.004
早产儿往往面临着围产期脑白质损伤的巨大风险,虽然肠道微生物与生命早期的发展有关,但目前研究人员并不是非常清楚早产儿机体中肠道微生物-免疫-大脑轴之间的详细关联。近日,一篇发表在国际杂志Cell Host & Microbe上题为“Aberrant gut microbiota-immune-brain axis development in premature neonates with brain damage”的研究报告中,来自维也纳大学等机构的科学家们通过研究发现了一种开发治疗大脑外损伤的早期疗法的可能性靶点,早产儿机体肠道菌群或许在其中就扮演关键角色,研究人员发现,胃肠道中克雷伯菌的过度生长或与早产儿机体特定免疫细胞数量的增加及神经性损伤的发生直接相关。
肠道、大脑和免疫系统的早期发展是密切相关的,研究人员将其称之为肠道-免疫-大脑轴,肠道菌群能与宿主机体免疫系统互相协作,后者能够监测肠道微生物并对其产生适当的反应;此外,肠道还能通过迷走神经和免疫系统来与大脑相互交流。研究者David Seki博士表示,这篇研究报告中,我们调查了上述轴线在极端早产儿大脑发育过程中所扮演的角色,肠道微生物组是多种细菌、真菌、病毒和其它微生物的重要合集,其在健康人群机体中处于平衡状态;然而,特别是在早产儿中,其机体免疫系统和微生物组并没有完全发育,很有可能会发生转变,而这些转变或会对宿主大脑产生负面的影响效应。
实际上,目前研究人员已经识别出了微生物组和宿主机体免疫反应的特定模式,这些模式与大脑损伤的进展和严重程度明显相关,而至关重要的是,这种模式往往在大脑变化之前就会出现,这就表明,或许存在一个关键的时间窗口,在此期间,极早产儿的大脑损伤或许可能会被预防防止恶化,甚至避免。研究人员所识别的生物标志物或能为开发合适的疗法提供新的起点,目前的研究数据表明,克雷伯菌的过度生长以及相关的γδ-T细胞水平的升高似乎会加剧大脑的损伤。
【6】Nature:代谢产物乙酸盐或能帮助控制机体复杂的肠道菌群平衡
doi:10.1038/s41586-021-03727-5
细菌在肠道中的定植和抑制之间的平衡对于人类和细菌之间的共生关系必不可少;维持粘膜表面平衡的一个重要组分就是免疫球蛋白A(IgA),其是哺乳动物机体中最丰富的免疫球蛋白;多项研究揭示了多反应性IgA的重要特征,其是在没有共生细菌的情况下自然产生的,然而,考虑到肠道环境中的动态变化,目前研究人员仍然不能确定共生反应性IgA是如何形成的,以及这种IgA如何影响机体的微生物群落。
近日,一篇发表在国际杂志Nature上题为“Acetate differentially regulates IgA reactivity to commensal bacteria”的研究报告中,来自日本理化学研究所等机构的科学家们通过研究发现,某些肠道菌群所产生的主要代谢产物—乙酸盐或参与到了调节其它肠道菌群的过程中;尤其是,实验结果显示,乙酸盐或能诱发机体抵御有害细菌的免疫反应,相关研究结果或能帮助开发新型疗法来调节机体肠道菌群的平衡。
肠道菌群能帮助将我们所摄入的食物分解为更小的碎片,即代谢产物,最近有研究表明,这些代谢产物会对肠道中的免疫功能产生明显的影响;尤其是,肠道菌群中的主要代谢产物—短链脂肪酸(SCFAs,short-chain fatty acids)或能产生并调节机体免疫细胞的功能,其被认为会增加IgA的产生,但截至目前为止,并没有人知道到底是什么会触发这种行为。这篇研究报告中,研究人员给予小鼠喂食一种能特异性增加其局部大肠区域的SCFAs的食物,随后对小鼠进行研究发现,一类名为乙酸盐的SCFAs能增加产生IgA的细胞和IgA的数量,并能调节IgA与每一种肠道菌群的结合程度。
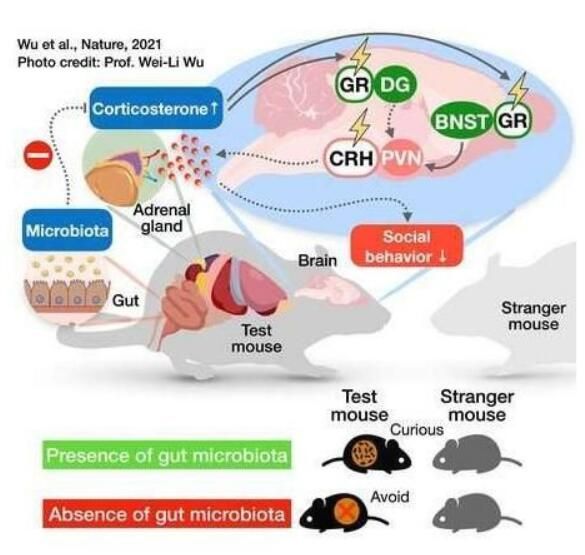
图片中展示的是当缺乏肠道微生物组时小鼠机体和大脑所发生的一系列改变。
图片来源:Wu, WL., et al.Nature (2021).doi:10.1038/s41586-021-03669-y
【7】Nature:科学家在小鼠机体中识别出肠道菌群和社交行为之间的神经关联
doi:10.1038/s41586-021-03669-y
动物之间的社会互动介导着基本的行为,包括交配、养育和防御。而肠道微生物群有助于促进小鼠的社会活动,但调节这种复杂行为的肠道-大脑关联及其背后潜在的神经基础,研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“Microbiota regulate social behaviour via stress response neurons in the brain”的研究报告中,来自加州理工学院等机构的科学家们通过研究在小鼠机体中识别出了肠道菌群和社会行为之间的神经关联;研究人员发现,生活在小鼠肠道中的细菌群落对于小鼠表现出正常的社会行为至关重要;而被培育出的无菌且没有肠道微生物组的小鼠则会表现出不同的反社会行为,比如会避开陌生的小鼠而不是与其互动,那么肠道菌群如何影响动物的行为呢?换句话说,从肠道菌群到大脑再到行为改变,在分子和细胞水平上到底发生着怎样的事件链?
这篇研究报告中,研究人员识别出了一种特殊的神经回路,其会被肠道菌群直接影响,随后对缺乏肠道微生物组的小鼠的反社会行为所“负责”,而将有健康肠道微生物组的小鼠机体的粪便移植到无菌小鼠体内则就能足以改变这些神经元的活性,并改善小鼠机体的社会行为。随后研究人员识别出了能够增加小鼠这种社交能力的特定细菌群落。
识别出肠道菌群、神经元和整个有机体健康效应之间的相互作用或许是一条非常重要的调查路线,未来或有望帮助改善机体的社会缺陷,比如机体中出现的那些与抑郁症和自闭症同时出现的缺陷。目前治疗这些类型问题的策略包括开药,比如抗抑郁药物和抗焦虑药物等。然而,研究人员很难让这些药物以正确的浓度进入到合适的大脑区域,而且大部分药物最终会在机体中消失;因此,理解脑肠轴之间的关联或能提供一定的证据,即通过治疗肠道微生物组可以间接改善机体的神经性精神障碍,而肠道菌群要比大脑更加容易进行药物治疗。
【8】Cell Host & Microbe:肠道菌群或和中风发生之间存在密切关联
doi:10.1016/j.chom.2021.05.002
临床研究表明,机体中肠道微生物衍生的代谢产物氧化三甲基胺(trimethylamine-N-oxide,TMAO)的循环水平与中风风险之间存在一定关联,然而目前研究人员并不清楚肠道菌群在中风发生上所扮演的关键角色。近日,一篇发表在国际杂志Cell Host & Microbe上题为“Gut microbes impact stroke severity via the trimethylamine N-oxide pathway”的研究报告中,来自克利夫兰诊所等机构的科学家们通过研究首次发现,肠道微生物组或会影响个体机体中风的严重程度以及中风后的功能障碍,相关研究结果有望帮助开发治疗或预防中风的新型干预措施。
本文研究基于科学家们进行了十多年的研究,他们旨在阐明肠道微生物组在人类机体心血管健康和疾病方面所扮演的关键角色,包括TMAO所产生的不利影响等,TMAO是肠道菌群消化红肉和其它动物产品中某些营养物质后所产生的代谢副产物。研究者Stanley Hazen说道,我们发现,饮食中的胆碱和TMAO能产生更大的中风规模和严重程度,同时还会给动物模型带来更差的结果;值得注意的是,仅仅通过移植肠道微生物来制造TMAO就足以引起中风严重程度的深刻变化。
此前研究人员发现,TMAO水平的升高或会诱发机体心血管疾病,在对数千名患者进行的临床研究中,他们发现,血液中TMAO的水平或能帮助预测患者因心脏病发作和中风以及死亡的风险,而且早先的研究也首次揭示了TMAO和血凝风险增加之间的关联。本文研究扩展了这些研究发现,并首次提供证据表明,肠道菌群(尤其是通过TMAO)或能直接影响机体中风的严重程度以及中风后机体的功能性障碍。研究人员在临床前中风模型研究中比较了TMAO水平升高或降低时的大脑损伤差异,随着时间延续,TMAO水平较高的个体在中风后往往会表现出更为广泛的脑部损伤以及更大程度的运动和认知功能缺陷;而且通过饮食改变策略(比如少吃红肉和鸡蛋)来改变TMAO的水平或许也会影响机体的中风严重程度。
【9】Nat Rev Immunol:疫苗效力或是一种机体的“肠道反应” 肠道菌群或是影响机体对疫苗免疫反应的关键因素
doi:10.1038/s41577-021-00554-7
机体对疫苗接种的免疫反应在不同个体和不同人群之间存在较大的差异,近日,一篇发表在国际杂志Nature Reviews Immunology上题为“Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms”的综述文章中,来自福林德斯大学等机构的科学家们表示,通过微生物菌群靶向性的干预措施来应对机体对疫苗接种的不同免疫反应,或能帮助婴儿、老年人和其他人群来充分利用有效疫苗的好处。
文章中,研究人员指出,如今来自临床试验和其它研究中越来越多的证据都表明,个体肠道菌群的组成和功能对于影响机体对疫苗接种的免疫反应至关重要。David Lynn教授表示,我们从未像现在这样需要从疫苗接种程序中获得强大且持久的免疫力,尤其是在中低收入国家,以及诸如婴儿或老年人等感染性疾病高风险易感群体中。
疫苗的保护作用是由能产生抗原特异性抗体的B细胞所诱导产生的,但T细胞也能帮助介导其它疫苗所诱导的保护性作用。肠道微生物菌群在不同个体之间也存在一定差异,而且在机体生命过程和全球不同人群之间差异也相对较大;其在调节B细胞和T细胞对疫苗的免疫反应上扮演着关键角色。更好地理解微生物调节这些疫苗反应的机制或能帮助使用更有针对性的人群特异性佐剂来增强机体对疫苗的反应。
【10】Immunity:肠道菌群失调促进肠道髓系细胞STING的积累进而推动肠道炎症
doi:10.1016/j.immuni.2021.05.008
cGAS-STING dna传感通路的改变影响肠道内稳态。在本研究中作者试图阐明STING在肠道炎症中的功能作用。在结肠炎的小鼠和患炎症性肠病的人类中,STING的表达增加是肠道炎症的特征。具有STING构成活性等位基因的小鼠表现出自发性结肠炎和生态失调,以及进行性慢性肠道炎症和纤维化。骨髓嵌合体实验显示STING在肠道巨噬细胞和单核细胞中的积累是炎症的最初驱动因素。总之,作者的研究结果表明,生物性失调促进STING在肠道髓系细胞的积累,驱动肠道炎症。
核酸检测是宿主防御的基石。外源DNA和宿主DNA通过胞质DNA传感器检测,导致急性炎症反应。环磷酸腺苷(CGAMP)合成酶(CGAS)是一种重要的DNA传感器,在抗病毒免疫中具有重要作用。然而,自身DNA激活cGAS也与无菌炎症有关。在DNA结合时,cGAS将ATP和GTP转化为非典型的环状二核苷酸cGAMP,而cGAMP反过来结合并激活内质网(ER)的宿主适配器蛋白sting。除cGAMP外,细菌产生的环二核苷酸(c-di-gmp)也能激活STING。STING激活导致干扰素调节因子-3(IRF3)依赖性的I型干扰素(IFN)应答、NF-kB依赖性的促炎细胞因子应答和自噬的寡聚和下游激活。在某些类型的细胞中,STING的激活也会导致细胞凋亡和坏死死亡。因此,STING可以被一系列信号激活,并触发过多的下游炎症反应。
由于cGAS-STING途径可以不区分宿主和外源DNA,许多稳态控制机制可以限制gas- sting的过度激活。例如,像TREX1这样的核酸酶会降解胞浆DNA,阻止cGAS连接和干扰素反应的下游激活。Trex1功能缺失突变导致Aicardi痛风综合征(AGS),一种以高水平干扰素刺激基因(ISG)表达为特征的干扰素病。STING的过度激活也与家族性冻疮狼疮和幼年发病的STING相关血管病变有关(SAVI)。SAVI是一种罕见的遗传病,由STING的功能获得杂合突变引起。savi相关突变导致了STING的结构性激活,这是独立于cGAMP结合的。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


