《自然》:mRNA疫苗打造超长待机抗癌T细胞!RNA新抗原疫苗可激活胰腺癌中的T细胞,激发针对胰腺癌的长期免疫活性
来源:奇点糕 2025-03-05 09:38
研究的结果为mRNA疫苗作为癌症辅助治疗提供了强有力的支持,特别是在针对肿瘤突变新抗原的个体化治疗方面。
近些年,mRNA疫苗在传染病防控领域发展得风生水起,2023年更是因为在Covid-19疫情防控中的应用潜力得到了诺贝尔奖的肯定。
其实,mRNA疫苗在癌症治疗领域的研究进展也是士别三日当刮目相待的程度,已经被用来硬刚“癌王”。就在2023年mRNA疫苗荣获诺奖的前几个月,抗癌mRNA疫苗有了突破性进展,纪念斯隆凯特琳癌症中心的Vinod P. Balachandran将一项临床试验的结果公布于《自然》期刊。
在这项治疗胰腺癌的I期临床研究中,由基因泰克和BioNTech公司共同开发的mRNA个体化新抗原疫苗表现出良好的安全性和出色的疗效,50%的患者对疫苗治疗产生应答,且mRNA疫苗与化疗和免疫治疗的序贯联用,使胰腺癌的复发和患者死亡风险,较未实现应答的患者下降了92%(HR=0.08)[1]。
时隔两年,Vinod P. Balachandran团队再次在《自然》杂志发布了这项试验的后续分析结果[2]。
结果表明,个体化定制的mRNA疫苗可以诱导胰腺癌患者产生肿瘤特异性的CD8阳性T细胞免疫应答,改善患者生存。这些T细胞能够在患者体内维持效应功能长达3年以上,部分T细胞甚至寿命超过10年,提供长期免疫保护。

新抗原是指由肿瘤细胞基因突变产生的特异性蛋白质片段,仅由肿瘤细胞表达,而在正常细胞中不存在。T细胞通过MHC分子识别到新抗原后,会将肿瘤细胞视为外来侵入者,从而发挥免疫反应。然而,胰腺导管腺癌(PDAC)往往无法产生高质量的新抗原,导致T细胞无法有效掌握敌情,难以出击。
个体化定制含有肿瘤新抗原的mRNA疫苗,不仅可以协助PDAC患者的免疫系统拉练T细胞,还有助于解决肿瘤异质性导致的新抗原个体间差异。
由Vinod P. Balachandran团队领导的这项I期临床试验共招募16名PDAC患者,目的是初步评估mRNA新抗原疫苗autogene cevumeran的可行性和安全性。患者在根治性手术后接受单剂量PD-L1抑制剂阿替利珠单抗治疗,研究者们根据其肿瘤样本制备mRNA疫苗;患者接受8剂autogene cevumeran注射后,再行12个周期mFOLFIRINOX方案辅助化疗,最后注射1剂加强针疫苗。
此次的结果显示,平均3.2年的随访期内,8名患者在接种疫苗后产生了强烈的新抗原特异性CD8+T细胞免疫应答,且没有出现肿瘤复发或死亡;其余8名对治疗没有应答的患者,中位无复发生存时间(RFS)为13.4个月(P=0.007;HR= 0.14, 95%CI 0.03–0.59)。
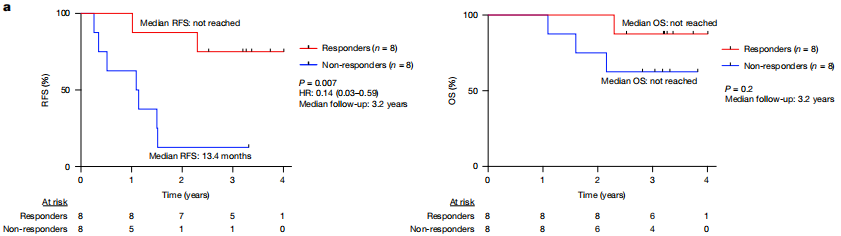
患者生存
研究团队使用CloneTrack技术,追踪了8名应答者的T细胞克隆动态变化。
结果显示,疫苗诱导产生了29种针对新抗原有特异性反应的T细胞克隆。这些T细胞在疫苗初始接种后经历了显著的扩增,约有77%在6次或更少的初始接种剂量后达到扩增峰值,扩增倍数可达100倍或更多。
研究者们发现,疫苗诱导产生的T细胞具有超长待机的特点,中位存活期为1.1年,半衰期约为40天。在接种加强针之后,这些T细胞的存活期更是显著延长,预计能达到7.7年,30%的T细胞克隆预估寿命甚至超过10年,可能比患者自身的存活时间还长。
在接种疫苗后的2年多时间里(中位随访2.95年),研究者们观察到86%的T细胞克隆仍然在患者的外周血中持续存活,占外周T细胞总数的0.07%左右,占比在接种疫苗3.8年后达到1.1%。
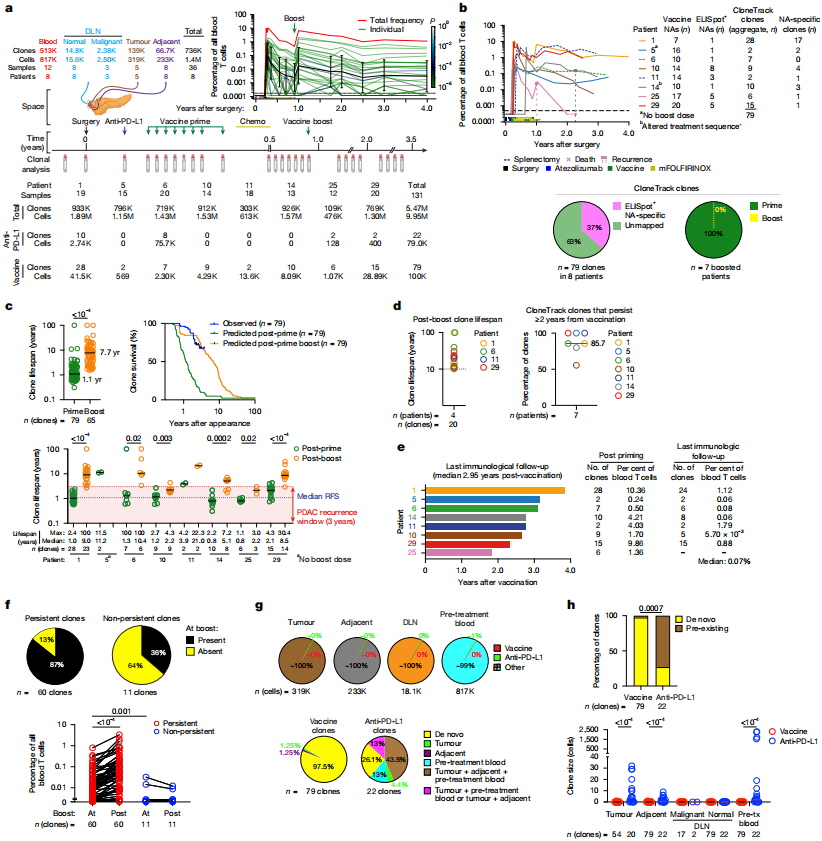
疫苗诱导产生长寿T细胞
除了活的时间长,这些T细胞还长期保持着工作能力,没有发生耗竭。从细胞表型来看,疫苗诱导产生的T细胞经历了从增殖状态到效应状态,再到组织驻留记忆T细胞样(TRM-like)状态的转变,并在TRM-like状态下保留较高的新抗原特异性效应功能。体外实验结果表明,在接种疫苗3.6年后,应答者的CD8+T细胞仍然能够有效识别和攻击新抗原,产生细胞因子IFN-γ、TNF-α并发挥细胞毒性作用。
应答者中,有2名患者肿瘤复发。研究者们发现,肿瘤复发的2名患者由疫苗诱导的新抗原特异性T细胞免疫反应较弱,且寿命短或免疫反应出现的时间晚。研究还表明,疫苗诱导产生的T细胞能够浸润到这些患者的复发病灶,并且携带疫苗新抗原的肿瘤细胞数量减少,表明疫苗的免疫反应对肿瘤细胞的突变产生了选择性压力。
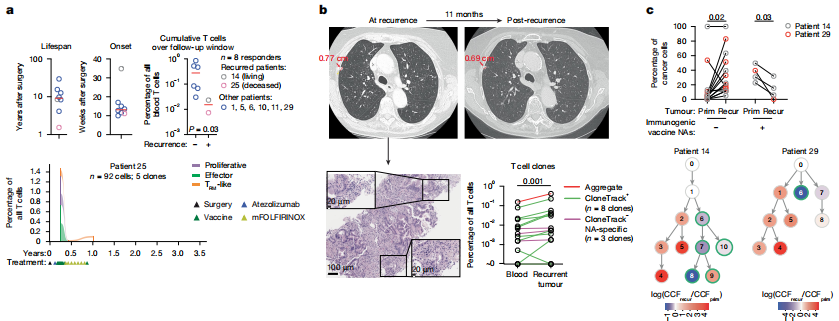
应答者的复发性肿瘤里有这些T细胞的浸润,影响了肿瘤细胞的突变方向
研究的结果为mRNA疫苗作为癌症辅助治疗提供了强有力的支持,特别是在针对肿瘤突变新抗原的个体化治疗方面。虽然还需要更多的临床试验来确认这些结果,但这一发现为未来抗癌mRNA疫苗的广泛应用奠定了基础。
参考文献:
[1]Rojas LA, Sethna Z, Soares KC, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023;618(7963):144-150. doi:10.1038/s41586-023-06063-y
[2]Sethna, Z., Guasp, P., Reiche, C. et al. RNA neoantigen vaccines prime long-lived CD8+ T cells in pancreatic cancer. Nature (2025). https://doi.org/10.1038/s41586-024-08508-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


