北京大学最新Cell子刊:激活肿瘤细胞焦亡,提高抗肿瘤免疫效果
来源:生物世界 2025-09-06 15:38
该研究开发了喜树碱增强型自发光纳米系统,高效激活肿瘤细胞焦亡以刺激抗肿瘤免疫,与抗 PD-L1 单抗联合使用时展现出卓越的抗肿瘤免疫效果。
肿瘤免疫疗法一直是一种很有前景的治疗方法,因其在摧毁肿瘤方面效果显著,尤其是在抑制肿瘤转移方面。在不同类型的免疫疗法中,基于 PD-1/PD-L1 通路的免疫检查点阻断(ICB)疗法在多种晚期癌症中取得了巨大成功,通过缓解免疫抑制微环境发挥作用。然而,免疫应答率低阻碍了 ICB 在肿瘤治疗中的疗效和广泛应用。
幸运的是,邵峰/刘志博等人发现,细胞焦亡(Pyroptosis)能够引发强烈且有效的免疫反应,不到 15% 肿瘤细胞发生焦亡就足以消除整个肿瘤,这为增强抗肿瘤免疫提供了一种很有前景的策略。
近日,北京大学第三医院梁晓龙团队在 Cell 子刊 Cell Biomaterials 上发表了题为:Camptothecin amplified self-luminous nanosystem for highly efficient activation of pyroptosis to stimulate antitumor immunity 的研究论文。
该研究开发了喜树碱增强型自发光纳米系统,高效激活肿瘤细胞焦亡以刺激抗肿瘤免疫,与抗 PD-L1 单抗联合使用时展现出卓越的抗肿瘤免疫效果。

细胞焦亡是一种新发现的免疫原性细胞死亡(ICD)类型,其特征在于在过程中释放不同的促炎细胞因子和警报素,从而引发强烈的抗原特异性免疫反应。此外,细胞焦亡还会释放炎症相关细胞内容物,显著增强肿瘤免疫原性。然而,如何安全且有效地触发肿瘤细胞焦亡,是个问题。
光动力疗法(PDT)和化疗能有效诱导细胞焦亡,但前者存在光穿透性差的问题,后者则面临耐药性难题。此外,传统的自发光光动力疗法依赖肿瘤微环境(TME)中的内源性过氧化氢(H₂O₂)和氧气(O₂),导致治疗效果不佳。
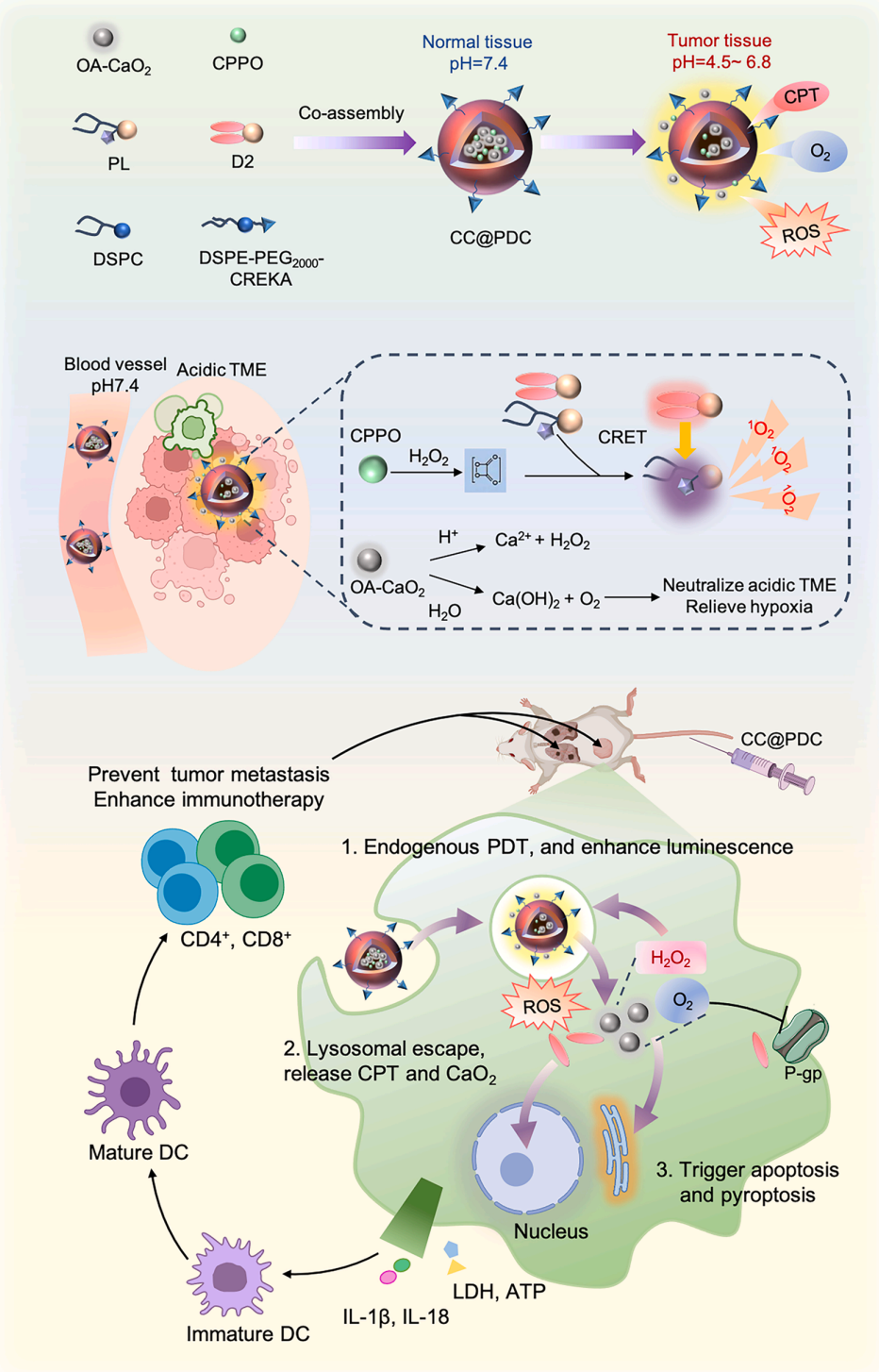
在这项新研究中,研究团队开发了一种自发光纳米颗粒——CC@PDC,它由两亲性卟啉脂质(PL)、喜树碱衍生物(D2)和靶向 DSPE-PEG2000-CREKA 自组装而成,同时封装了油酸修饰的过氧化钙(OA-CaO₂)和双[3,4,6-三氯-2-(戊氧羰基)苯基]草酸酯(CPPO)。在酸性的肿瘤微环境中,CaO₂ 提供 O₂ 和 H₂O₂,与 CPPO 反应,促使喜树碱在 420 纳米处发出强光,从而很好地激发卟啉产生活性氧(ROS)。此外,喜树碱作为一种化疗药物能够缓慢释放,从而实现了喜树碱增强型自发光光动力化疗,有效诱导肿瘤细胞焦亡,并且其与 αPD-L1 抗体联合使用时展现出卓越的抗肿瘤/免疫效果。
该研究的核心发现:
自发光纳米颗粒能在肿瘤内部发光,无需外部光源;
级联能量转移增强活性氧生成,实现强大的肿瘤杀伤作用;
化疗与自增强光动力疗法协同激活细胞焦亡;
细胞焦亡驱动的免疫激活增强 PD-L1 治疗的抗肿瘤反应。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


