Science子刊:南京大学殷武团队揭示非小细胞肺腺癌免疫逃逸新机制
来源:生物世界 2023-02-17 09:34
该研究拓展了EO的新生物学功能,为发现肿瘤免疫逃逸新机制、提高肺腺癌免疫治疗效果提供理论依据。
非小细胞肺癌(NSCLC)是威胁人类健康的重大疾病,在全世界范围内呈现发病率与死亡率逐年上升的趋势,85%的NSCLC病理分型属于肺腺癌。免疫检查点抑制剂的出现为NSCLC治疗带来曙光,靶向PD-1/PD-L1的抗体药物Pembrolizumab是获批治疗晚期与转移性NSCLC的一线药物。虽然这些药物在治疗转移性或局部晚期NSCLC中显示了较好的疗效,但仅15%-30%晚期NSCLC患者可以从免疫治疗中获得持续缓解和长期生存,抑制性肿瘤免疫微环境其主要原因。因此,探索抑制性TIME形成的驱动因素,对提高NSCLC免疫治疗效果具有十分重要的意义。
内分泌激素与肿瘤免疫关系密切。在一些内分泌相关肿瘤中(如乳腺癌等),激素参与肿瘤免疫调节的研究已经相当深入,内分泌治疗也已经成为这些肿瘤治疗的重要手段。NSCLC并不是严格意义上的内分泌相关肿瘤,但越来越多的研究表明肺癌细胞的增殖与转移受多种激素的调节,在NSCLC细胞膜表面分布有多种激素的受体,然而,医学界对内分泌激素如何参与NSCLC肿瘤免疫微环境调节,如何影响NSCLC免疫疗效知之甚少。
近日,南京大学生命科学学院殷武教授课题组在 Science 子刊 Science Advances 上发表了题为:Na, K-ATPase α1 cooperates with its endogenous ligand to reprogram immune microenvironment of lung carcinoma and promotes immune escape 的研究论文。
殷武教授课题组长期围绕肾上腺产生的内分泌激素物质——内源性哇巴因(Endogenous Ouabain,EO)的新生物功能展开研究,通过大量的临床样本检测与生物学功能确认,发现了EO是一种能促进NSCLC抑制性免疫微环境的新内分泌激素物质。

哇巴因是一种高等植物产生的抵抗昆虫入侵的化学武器,但在非小细胞肺腺癌患者血液中检测到异常高表达的EO,且EO表达量与肿瘤转移、患者预后密切相关。进一步研究发现在肺腺癌进展中,肾上腺能够被肿瘤“劫持”释放EO,进入肺腺癌微环境中的EO “巧妙”地利用钠钾ATP酶受体“脱敏”精密调控PD-L1表达,促进肿瘤免疫逃逸,成果的新颖性获得国际同行专家的高度评价。
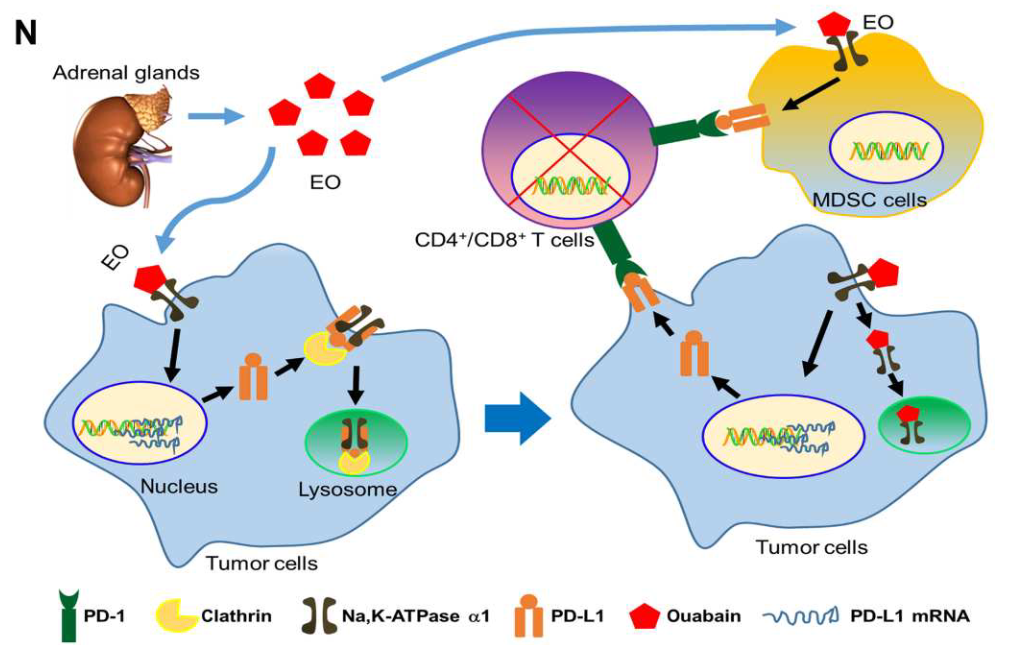
该研究拓展了EO的新生物学功能,为发现肿瘤免疫逃逸新机制、提高肺腺癌免疫治疗效果提供理论依据。
南京大学生命科学学院博士生杨开勇与李子剑为论文第一作者,殷武教授为通讯作者。殷武教授长期从事钠钾ATP酶新生物学功能研究,并基于内源性哇巴因新功能从中药强心甾化合物库中寻找新候选药物与对应新适应症。已经在EMBO Mol Med,Leukemia,J Am Soc Nephro.等多个国际权威期刊上发表相关研究论文,获得多项专利授权与科技奖项。该项目得到国家自然科学基金重大研究计划在内的多项国家级课题与江苏省重点研发计划的支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


