PNAS:王本/张进团队构建基因编辑的iPSC来源的CAR-巨噬细胞,实现更好的实体瘤免疫治疗
来源:生物世界 2023-09-13 17:23
综合来看,该研究发现了肿瘤细胞表面的唾液酸在抗体依赖性细胞吞噬(ADCP)和细胞介导的细胞毒性(ADCC)中的抑制作用,有针对性地清除肿瘤细胞表面的唾液酸显著增强了巨噬细胞对肿瘤细胞的敏感性。
浙江大学转化医学研究院/医学院附属第二医院王本课题组与良渚实验室/浙江大学基础医学院张进课题组合作,在《美国国家科学院院刊》(PNAS)上发表了题为:Targeted glycan degradation potentiates cellular immunotherapy for solid tumors 的论文。
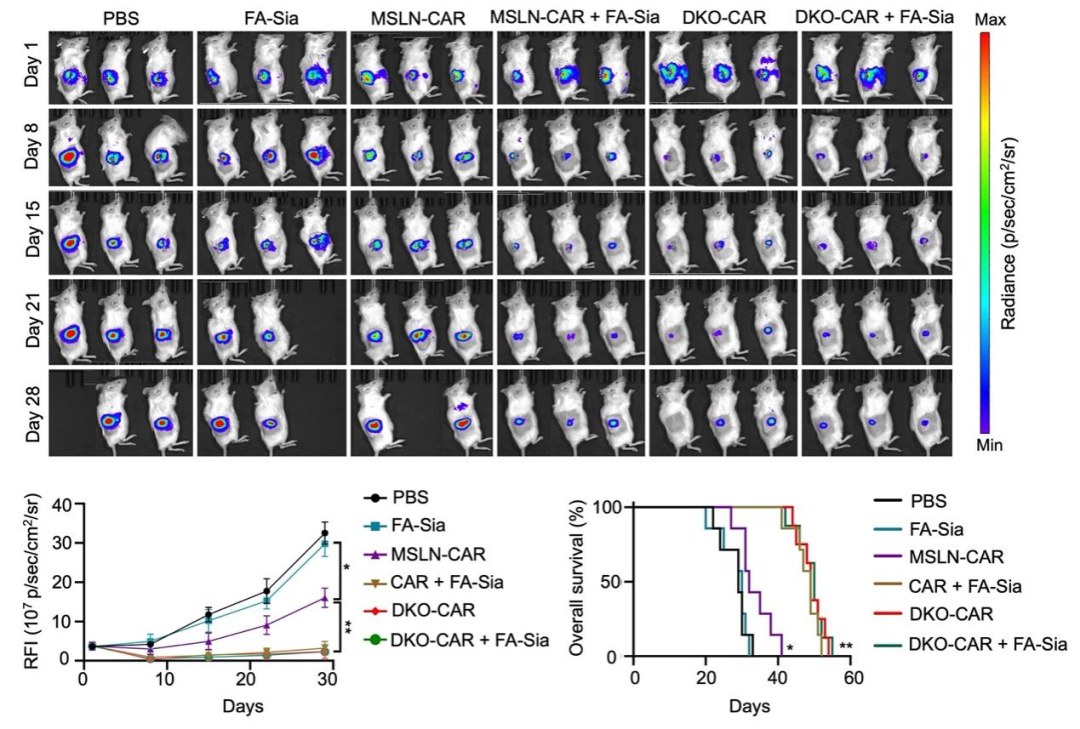
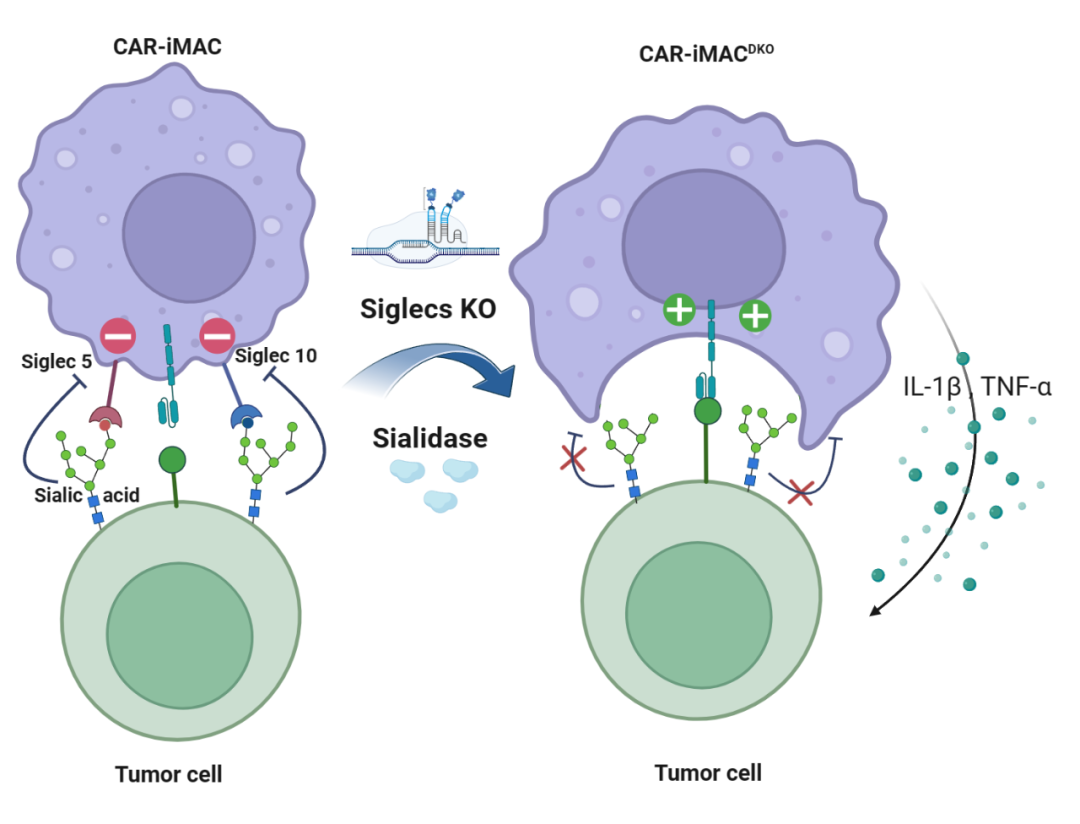
该研究发现了唾液酸酶与人诱导多能干细胞(iPSC)来源的CAR-巨噬细胞(CAR-iMac)联用可以显著增强CAR-iMac的抗实体瘤功能。另外,同时敲除巨噬细胞表面与唾液酸酶结合的免疫检查点Siglec-5和Siglec-10(DKO-CAR-iMac)也可以显著增强CAR-iMac的抗实体瘤功能。
这些发现为髓系细胞在细胞免疫治疗上的应用提供了新思路。CAR-T细胞疗法先驱、宾夕法尼亚大学的 Carl June 教授是这篇论文的责任编辑。

外周血单核细胞(PBMC)来源的原代巨噬细胞无法高效进行基因编辑和工程化改造,因此iPSC来源的巨噬细胞(iMac)成为髓系细胞免疫治疗的重要来源。研究团队首先用唾液酸酶预处理卵巢癌细胞SKOV3,并将SKOV3细胞与靶向间皮素的CAR-iMac(MSLN-CAR-iMac)共培养。结果表明,唾液酸酶的预处理不会影响肿瘤细胞自身的生长速度,但可以显著提高MSLN-CAR-iMac对卵巢癌细胞的吞噬能力。研究团队还发现,唾液酸酶的预处理提高了共培养体系中M1型CAR-iMac的比例和肿瘤坏死因子α(TNF-α)的分泌(图1)。
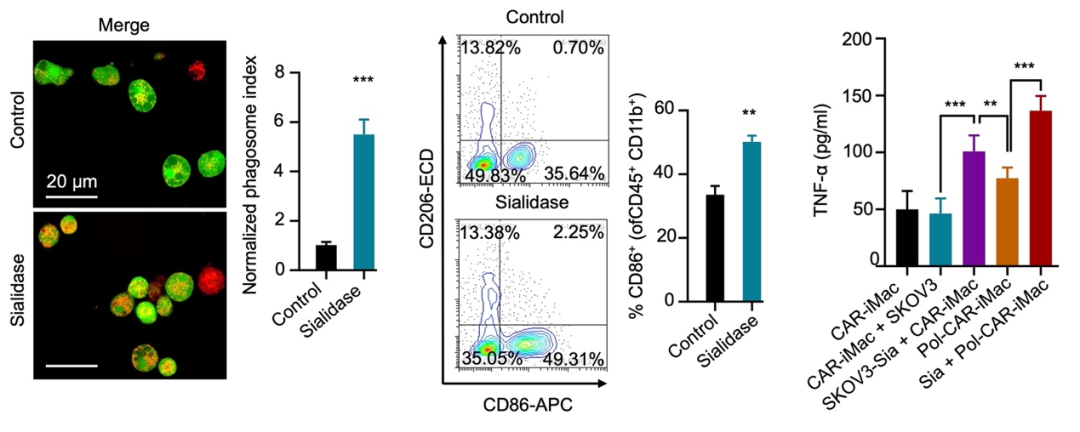
图1. 唾液酸酶提高了CAR-iMac的促炎极化水平和对肿瘤细胞的吞噬能力
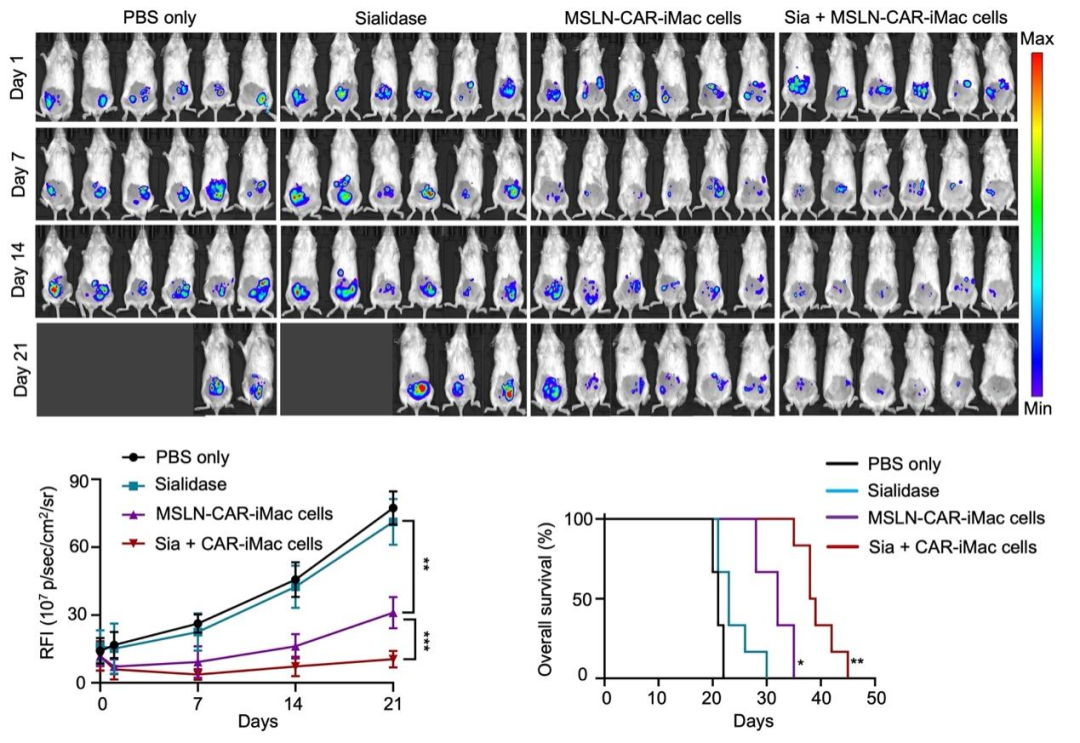
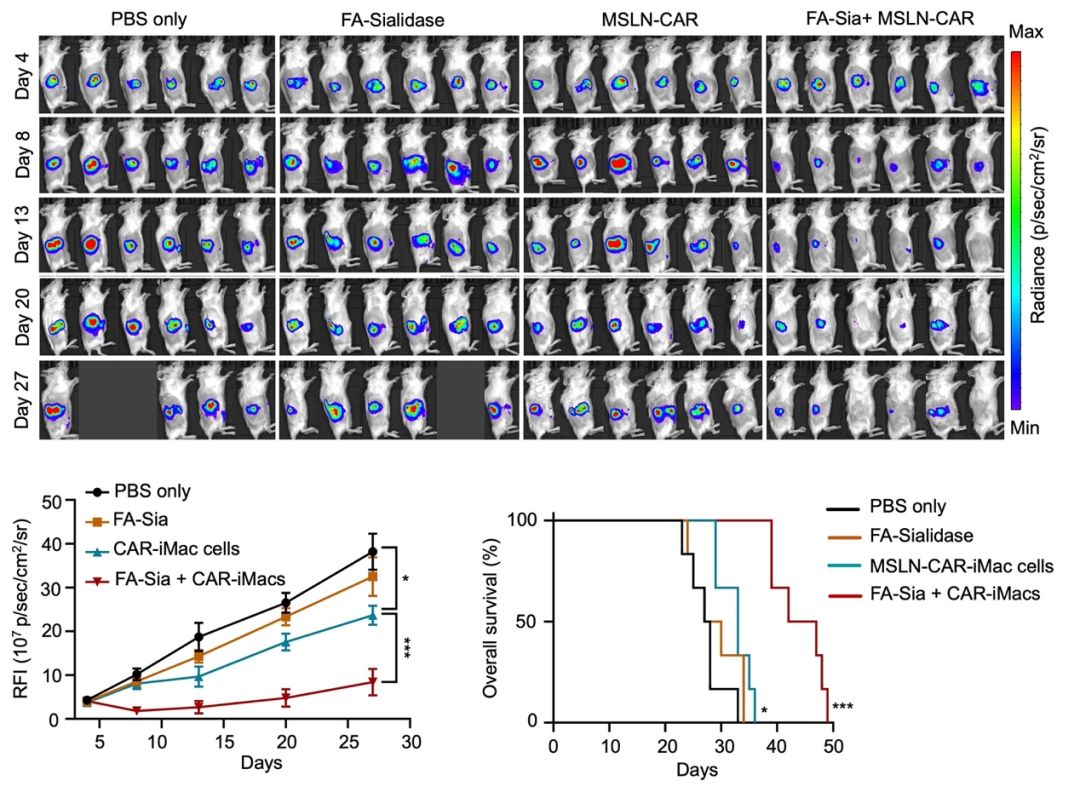
研究团队还用NSG小鼠构建了卵巢癌转移小鼠模型,并观察了通过腹腔注射CAR-iMac和唾液酸酶治疗后小鼠肿瘤的变化。可以看到,单独的唾液酸酶几乎没有治疗作用,而唾液酸酶与CAR-iMac联用可以显著抑制肿瘤生长并延长了小鼠的生存期(图2)。后续在胰腺癌小鼠模型中与原位卵巢癌小鼠模型中也分别观察到唾液酸酶与CAR-iMac联用可以显著延长小鼠的生存期(图3)。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


