天津医科大学肿瘤研究所的研究者们揭示了促进乳腺癌的进展的关键信号机制
来源:生物谷原创 2023-12-29 14:55
活化C蛋白受体1(RACK1)是色氨酸-天冬氨酸重复序列(WDR)蛋白家族的一员。RACK1最初被鉴定为激活的PKC激酶的结合伙伴。
活化C蛋白受体1(RACK1)是色氨酸-天冬氨酸重复序列(WDR)蛋白家族的一员。RACK1最初被鉴定为激活的PKC激酶的结合伙伴。后来的研究表明,RACK1是一种多功能支架蛋白,可以与多种受体蛋白和蛋白激酶相互作用,包括AR、IGF1R、Src、FAK、PKM2和FGFR。
因此,RACK1参与多种细胞信号通路,调节许多生理或病理细胞活动。根据其结合蛋白的不同,RACK1在不同的组织和细胞中表现出不同的功能。RACK1的异常表达或其信号通路的改变与多种疾病有关,但其机制尚不清楚。

图片来源:https://doi.org/10.1038/s41419-023-06191-3
近日,来自天津医科大学肿瘤研究所的研究者们在Cell Death and Disease杂志上发表了题为“RACK1 facilitates breast cancer progression by competitively inhibiting the binding of β-catenin to PSMD2 and enhancing the stability of β-catenin”的文章,该研究揭示了RACK1通过竞争性抑制β-连环蛋白与PSMD2的结合和增强β-连环蛋白的稳定性促进乳腺癌的进展。
活化C蛋白受体1(RACK1)是一种重要的支架蛋白,具有多功能和多方面的特性。通过调节蛋白质之间的相互作用,RACK1整合了多种细胞内信号,参与了各种生理和病理过程的调节。RACK1的异常调节与许多肿瘤的发生和发展有关。然而,RACK1在癌细胞过程中的确切功能,特别是在增殖过程中的作用,仍然存在争议。
在本研究中,研究者证明了RACK1是乳腺癌细胞体外增殖和体内肿瘤生长所必需的。RACK1的这种作用与其增强β-连环蛋白稳定性和激活乳腺癌细胞中典型的WNT信号通路的能力有关。
研究者鉴定了蛋白酶体的关键成分PSMD2是RACK1和β-连环蛋白的新的结合伙伴。有趣的是,虽然RACK1与β-连环蛋白之间没有相互作用,但RACK1与β-连环蛋白竞争性地结合。此外,RACK1阻止泛素化的β-连环蛋白与PSMD2结合,从而保护β-连环蛋白不被蛋白酶体降解。总而言之,研究者发现揭示了一种新的机制,通过该机制,RACK1增加了β-连环蛋白的稳定性,促进了乳腺癌的增殖。
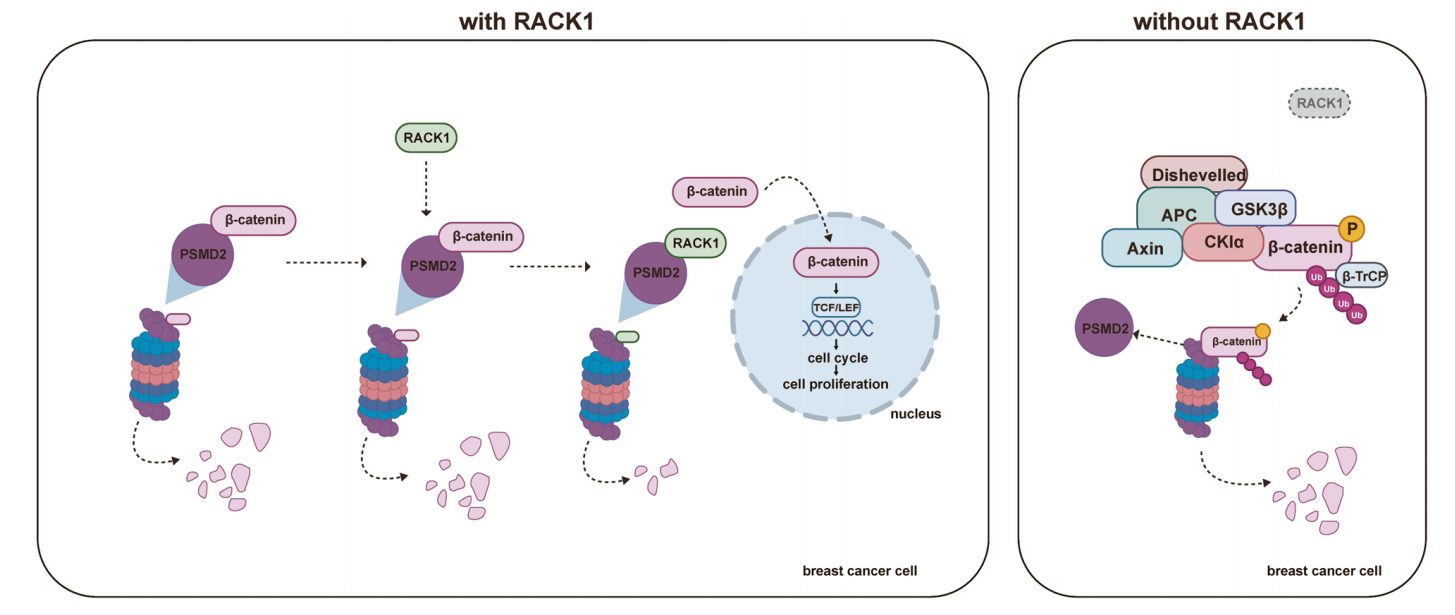
机制总结图
图片来源:https://doi.org/10.1038/s41419-023-06191-3
总之,本研究结果表明,RACK1通过增强β-连环蛋白的稳定性而促进乳腺癌的进展。研究者发现pMD2是RACK1与β-连环蛋白的一个新的结合伙伴,虽然RACK1不与β-连环蛋白结合,但它抑制了pMD2与β-连环蛋白的相互作用以及随后的蛋白酶体介导的降解。因此,研究者揭示了PSMD2、RACK1和β-连环蛋白之间的一种新的相互作用模式,这可能是一种参与调节WNT途径激活的机制,靶向这一途径可能是治疗乳腺癌的有效途径。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


