Journal of Cell Biology:研究发现ALS/FTD致病蛋白TDP-43和CHMP2B之间的“分子连接”CK1
来源:上海有机化学研究所 2021-11-05 12:48
含有RNA结合蛋白TAR DNA-binding protein (TDP-43) 的异常蛋白聚集是肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis, ALS) 和额颞叶痴呆 (frontotemporal dementia, FTD) 的关键病理标志物。ESCRT复合物蛋白charged multivesicul
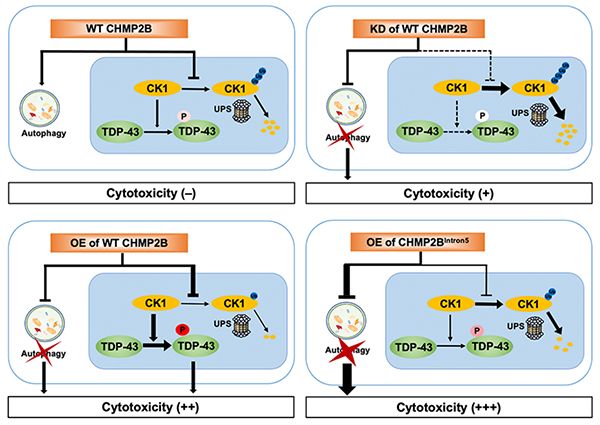
含有RNA结合蛋白TAR DNA-binding protein (TDP-43) 的异常蛋白聚集是肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis, ALS) 和额颞叶痴呆 (frontotemporal dementia, FTD) 的关键病理标志物。ESCRT复合物蛋白charged multivesicular body protein 2B(CHMP2B)也是一个与ALS和FTD都相关的致病蛋白,普遍认为其致病机制主要是其突变引起内溶酶体-自噬通路功能障碍导致。尽管超过95%的ALS病人和近45%的FTD病人中有TDP-43蛋白的异常聚集,在CHMP2B最常见的CHMP2BIntron5突变引起的FTD中没有检测到TDP-43蛋白的异常改变。在以前发表的工作中,尚无把TDP-43和CHMP2B这两个与ALS/FTD均相关的致病蛋白进行分子机制上的关联研究。
中国科学院上海有机化学研究所生物与化学交叉研究中心研究员方燕姗课题组在Journal of Cell Biology上,在线发表了题为CHMP2B regulates TDP-43 phosphorylation and cytotoxicity independent of autophagy via CK1的论文,该研究发现了CHMP2B可以通过非自噬依赖的途径调控TDP-43的磷酸化和细胞毒性。
该工作中,研究人员首先通过果蝇筛选实验发现CHMP2B的敲低可以改善TDP-43引起的神经退化的表型,进而综合利用果蝇模型、哺乳动物细胞系和小鼠原代神经元等实验体系,揭示了CHMP2B可以通过调节蛋白激酶CK1的泛素化和由蛋白酶体介导的CK1蛋白降解过程来改变CK1的蛋白水平,从而最终影响TDP-43蛋白的磷酸化。CK1在CHMP2B调控TDP-43磷酸化中的作用具有特异性,因为只有改变CK1可以干预CHMP2B对TDP-43磷酸化水平的调节,而操纵另一个已知的TDP-43蛋白激酶TTBK1/2无法改变CHMP2B对TDP-43磷酸化水平的影响。
研究还发现,CHMP2B在自噬通路中的作用和对TDP-43磷酸化的影响可以同时但独立地参与到细胞毒性和神经退化中。特别是,在CHMP2B基因中同一个位点的突变对这两种功能的影响可以是不同的、甚至是相反的。该发现有助于理解为什么CHMP2BIntron5引起的FTD病人罕有TDP-43蛋白聚集或高度磷酸化的TDP-43的检出。此外,该工作还证明了CK1的抑制剂对于TDP-43和CHMP2B引起的神经细胞毒性均有抑制作用,为发展治疗ALS/FTD以及相关神经退行性疾病的新药提供了方向。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


