汕头大学黄承扬团队揭示表观遗传调控因子驱动干细胞衰老的关键机制
来源:网络 2024-01-08 11:21
转录和表观遗传失调损害大脑老化过程中增殖性神经干细胞/祖细胞(NSPC)的产生,揭示了驱动干细胞衰老的关键内在机制,并确定了可能恢复衰老干细胞功能的潜在靶点。
干细胞衰老是一种自然而不可避免的生物过程,其特征是细胞内在通路和干细胞微环境外部因素的影响导致的退行性变化。在啮齿动物大脑中,大多数具有自我更新和分化为神经元的神经干细胞/祖细胞(NSPC)存在于室管膜下区(SVZ)。在SVZ内,神经干细胞(NSC)被鉴定为胶质样B1细胞,可以以相对较慢的速度被激活分裂。激活的B1细胞(B1a型)产生C型转录扩增祖细胞,这些细胞具有快速分裂的能力。随后,C型细胞产生未成熟的A型成神经细胞(Neuroblast),进一步分化为神经元,从而在脑再生中发挥关键作用。
在衰老的大脑中,NSPC数量和神经发生减少。与年龄相关的NSPC缺陷已经被认为与认知障碍和神经退行性疾病有关,因此了解NSPC衰老的分子机制至关重要。
2024年1月4日,汕头大学医学院黄承扬团队在 Nature 子刊 Nature Aging 上发表了题为:Transcriptional and epigenetic dysregulation impairs generation of proliferative neural stem and progenitor cells during brain aging 的研究论文。
该研究表明,转录和表观遗传失调损害大脑老化过程中增殖性神经干细胞/祖细胞(NSPC)的产生,揭示了驱动干细胞衰老的关键内在机制,并确定了可能恢复衰老干细胞功能的潜在靶点。
在大脑发育过程中,由序列特异性转录因子和表观遗传调节因子动态复合物调控的转录程序在神经干细胞增殖和分化中发挥关键作用。干细胞的谱系特异性是一个动态过程,在神经发育过程中确定,并与全基因组的表观遗传标记和转录组谱的变化相关。成年NSC保持相对静止状态,以保持大脑SVZ中的NSC库,但在衰老过程中可以被激活成为活跃的NSPC或增殖细胞。
转录和表观遗传调控已成为参与NSPC衰老的潜在内在机制,这在SVZ组织中与年龄相关的转录组和表观基因组变化的研究中得到了证实。然而,对于衰老NSPC的转录组和表观基因组中与年龄相关的变化,以及年龄相关基因的功能分析,仍然缺乏综合分析,这使得它们是因果因素还是只是在衰老过程中积累的标志物尚不清楚。此外,基因调控元件表观遗传修饰的缺失如何导致年龄依赖性转录程序失活并驱动细胞衰老仍在很大程度上未知。
该研究发现,雄性小鼠大脑中神经干细胞/祖细胞(NSPC)的衰老表现为增殖性NSPC的生成效能下降,而不是NSPC谱系特异性的变化。 揭示了NSPC中年龄依赖性基因的下调通过减少活跃增殖NSPC的数量而增加静止标志物的表达来驱动细胞衰老。 该研究发现,MLL复合物在启动子处的表观遗传失调导致年龄依赖性基因的转录失活,突显了组蛋白修饰物和基因调控元件之间动态相互作用在调节衰老细胞转录程序中的重要性。
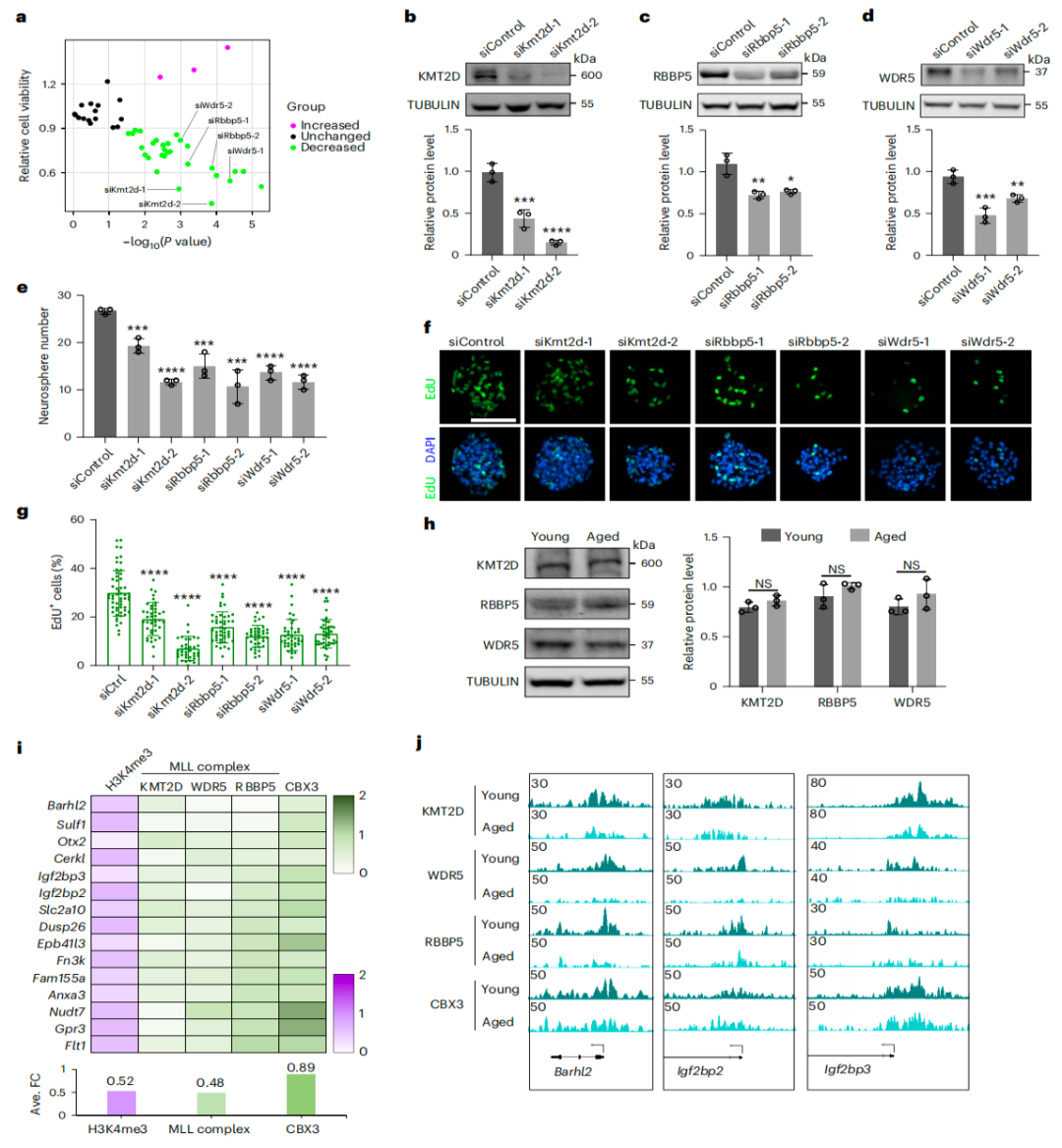
MLL复合物是衰老NSPC功能功能下降的关键调控因子
总的来说,该研究表明,转录和表观遗传失调损害大脑老化过程中增殖性神经干细胞/祖细胞(NSPC)的产生,揭示了驱动干细胞衰老的关键内在机制,并确定了可能恢复衰老干细胞功能的潜在靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


