《细胞》重磅:发现全新神经细胞!斯坦福团队发明从发育中大脑分离不同细胞类型的新方法
来源:奇点糕 2023-04-06 16:09
本研究成功开发了一种可以根据细胞表面标志从发育中的大脑中分离出不同NSPC类型的方法,并进行了分离细胞的功能验证。这种方法简单高效,很容易推广。
连续霸榜9年的全球最大公司沃尔玛员工人数为200多万,这已经让人惊叹,得是什么样的管理和运行制度能让这样的庞然大物有条不紊地运转。
不过,这样的规模和大脑的“员工”规模比起来,可谓小巫见大巫。人的大脑拥有大约1710亿个细胞,这些细胞均各司其职以维持你的一切生命活动[1]。
更为让人惊叹的是,这些细胞均起源于相同的祖先——神经干细胞和前体细胞(NSPC)[2]。近年来,单细胞测序技术使得我们对于NSPC有了更深刻的认识,NSPC内部存在多种转录特征不同的群体[3]。然而,如何将这些具有不同功能的NSPC亚群分离和纯化,制约着科学家们对神经细胞分化和功能的进一步探索。
近日,来自斯坦福大学的Rahul Sinha和Irving L. Weissman团队,在《细胞》杂志发表重磅研究成果[4]。他们将荧光激活细胞分选(FACS)和单细胞测序技术相结合,设计了一种可从孕中期人脑组织中纯化NSPC亚类的方法。
研究人员利用此方法,可同时纯化10种不同的NSPC亚群,包括放射状胶质细胞(RG,神经干细胞)、神经元前体细胞、少突胶质细胞前体细胞和星形胶质细胞谱系细胞等。同时,研究人员进一步证明了这些纯化的NSPC亚群在体外和体内的功能特性,并确定了一种此前从未报道过的双能神经胶质祖细胞,其仅产生星形胶质细胞和少突胶质细胞,不能分化为神经元。
该技术有助于未来对神经发育的研究,并对基于NSPC移植的治疗方案具有推动作用。
论文首页截图
为了分离纯化NSPC亚群,研究人员首先将孕17-19周的胎儿脑组织分离成单细胞悬浮液,然后通过一系列细胞表面标志物抗体对细胞进行FACS,并根据细胞表面标志物表达情况将细胞分组,接着对分组的细胞进行了单细胞RNA测序(scRNA-seq)。这样研究人员就可以把每个细胞的表面标志与转录特征相结合。
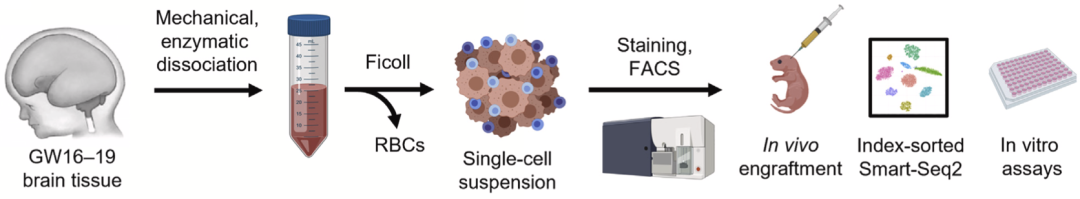
NSPC分离和表征的步骤以及后续实验流程
依据不同类型细胞的标志基因与转录特征,这些细胞被分为了12个亚群。
通过比较表面标志物的RNA与蛋白表达情况,研究人员发现这两者之间并不总是完全相关,尤其是糖基磷脂酰肌醇锚定的表面分子THY1和CD24。这表明,依据细胞蛋白进行细胞分群,可能更加适合后续的细胞功能分析。
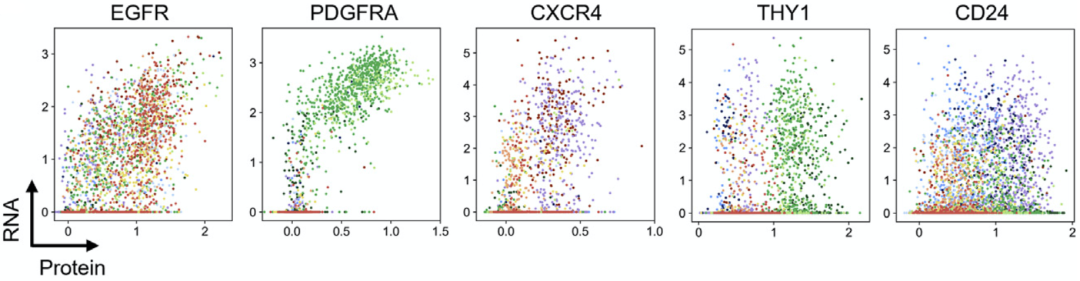
表面标志物的RNA与蛋白表达情况并不总是完全一致
通过比对细胞表面标志物和依据转录特征推测得到的细胞亚群,研究人员发现神经干细胞(NSC)可被CD24阴性-THY1阴性或低表达(CD24-THY1-/low)门控通道所分离,少突胶质细胞谱系可被THY1高表达(THY1hi)门控通道所分离,神经元谱系可被CD24阳性-THY1阴性或低表达(CD24+THY1-/low)门控通道所分离。
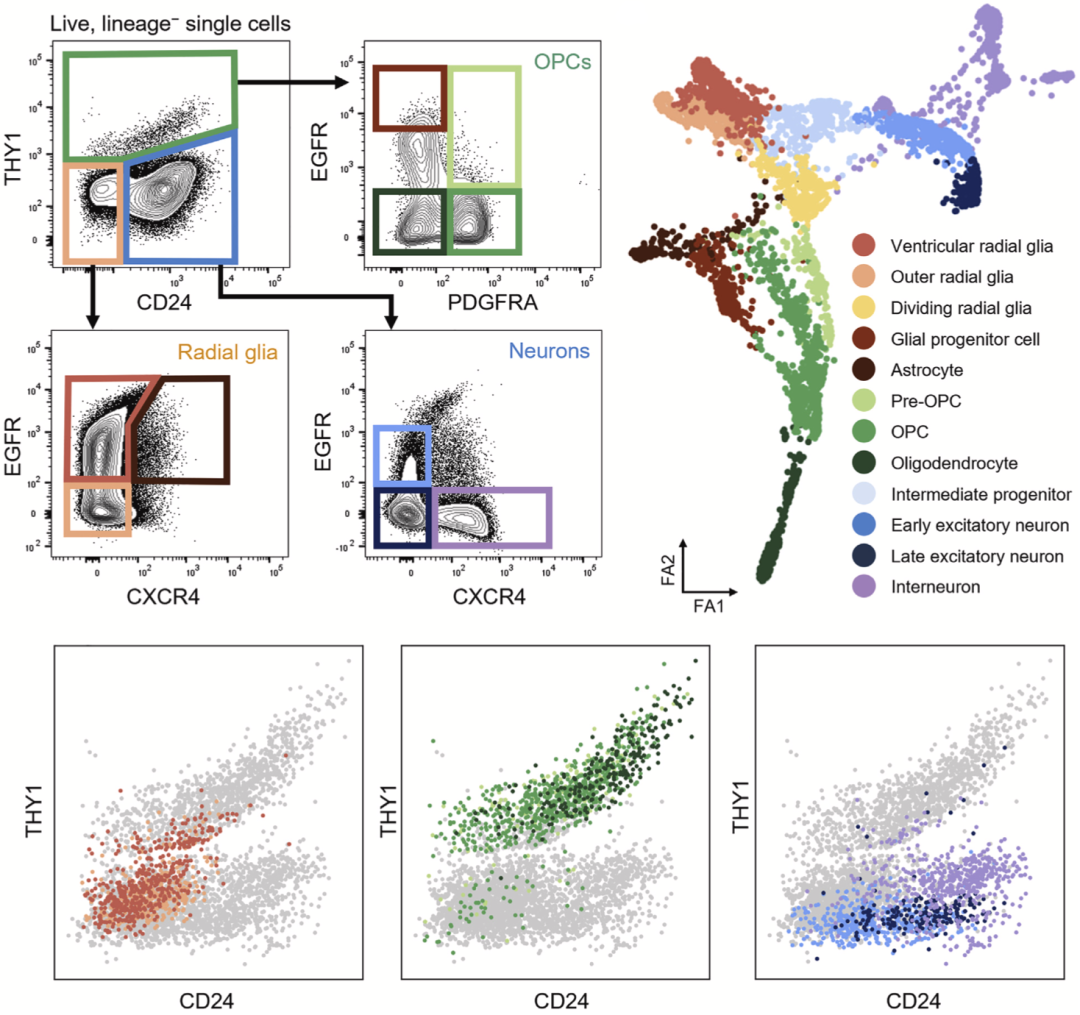
通过CD24-THY1门控通道可分离NSC、少突胶质细胞谱系和神经元谱系
在CD24-THY1-/low门控所分离得到的NSC中,进一步依据其他表面标志物门控通道(EGFR和CXCR4),可进一步分离为脑室RG(vRG,EGFRhi)、脑室上区外侧RG(oRG,EGFR-)和星形胶质细胞谱系(EGFR+CXCR4+)。
紧接着,为了验证CD24-THY1-/low门控所分离到的NSC功能,研究人员在体外和体内对其自我更新和分化的能力进行了验证。
首先,这群NSC在体外可形成神经球,这与干细胞的生长特征相符。
其次,这些细胞在体外可分化为神经元(DCX+)、星形胶质细胞(GFAP+)和少突胶质细胞(O4+),表明了其具有多能分化的潜力。
最后,研究人员直接将分选出的细胞移植到了新生NOD-scid-IL2Rgnull小鼠(NSG小鼠,T细胞、B细胞和NK细胞均功能缺失,严重免疫缺陷)的侧脑室。在6个月后,移植的NSC可在NSG小鼠脑内广泛迁移,并分化为神经元、星形胶质细胞和少突胶质细胞。
此外,研究人员还发现,CD24-THY-/lowEGFRhiNSC细胞相比于CD24-THY-/lowEGFR-NSC细胞具有更强的增殖潜能,前者分化出的少突胶质细胞和星形胶质细胞分别是后者的1.8倍和2.3倍。这与先前在小鼠研究中报道的EGFR可促进细胞增殖和星形胶质细胞生成的结果相一致[5]。
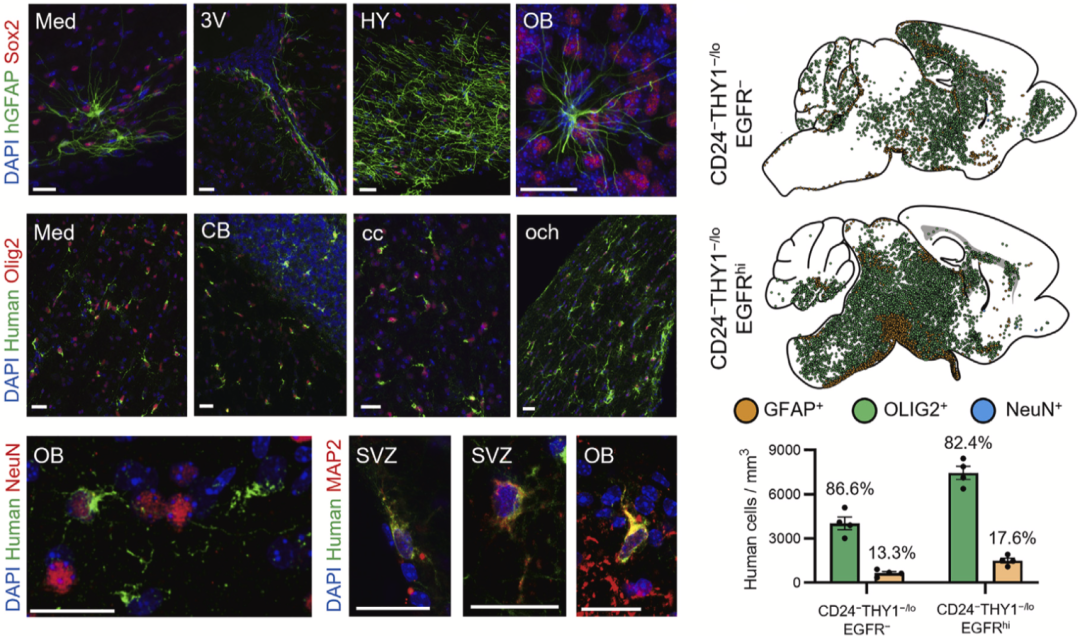
CD24-THY1-/low门控所分离NSC可在NSG小鼠脑内广泛迁移和分化
以上结果证实,研究人员通过新方法所分离到的被推测为NSC的细胞群体,确实具有干细胞的相关功能,在体外和体内均可增殖和分化。
接下来,他们又分别验证了THY1hi门控通道所分离到的少突胶质细胞谱系,以及CD24+THY1-/low门控通道所分离到的神经元谱系的功能。
值得注意的是,他们在使用scRNA-seq数据进行分群时,发现了一群同时具有星形胶质细胞和少突胶质细胞基因表达特征的细胞,并将其命名为双能神经胶质祖细胞(GPC)。GPC可被THYhiEGFRhiPDGFRA-门控通道所分离。人类胎儿脑组织的免疫染色也证实了这种细胞(GFAP+OLIG2+)的存在,其位于脑室上区外侧,很可能来自于oRG。
GPC在体内和体外均可分化为星形胶质细胞和少突胶质细胞,唯独不分化为神经元。这再次证明了本研究中所采用的细胞分离纯化方法的准确性和有效性。
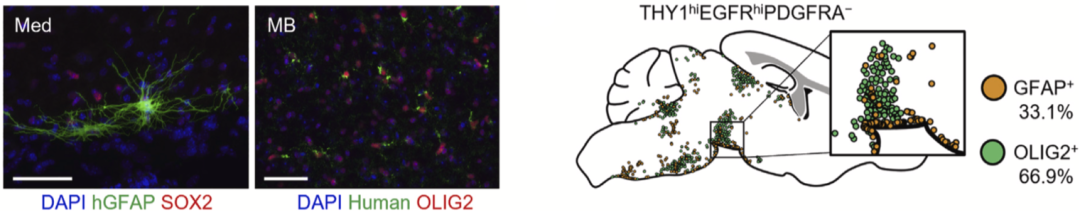
GPC在体内可分化为星形胶质细胞和少突胶质细胞,但不分化为神经元
最后,研究人员对胎儿大脑不同的13个区域(包括不同皮质区域和皮质下区域)进行了细胞分离提纯,证实了该NSPC分选方法适用于大脑的各个区域,并具有很好的重复性和准确性。
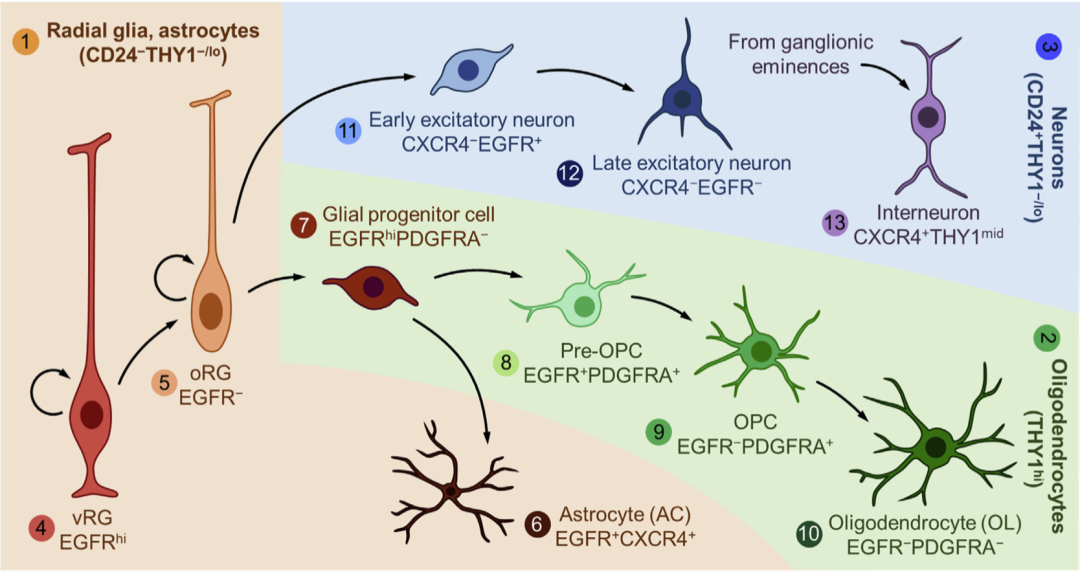
研究所分离纯化的10种NSPC亚类
总的来说,本研究成功开发了一种可以根据细胞表面标志从发育中的大脑中分离出不同NSPC类型的方法,并进行了分离细胞的功能验证。这种方法简单高效,很容易推广。
参考文献
1.https://medicalxpress.com/news/2023-03-method-function-neural-stem-cells.html
2.Noctor SC, Flint AC, Weissman TA, Dammerman RS, Kriegstein AR: Neurons derived from radial glial cells establish radial units in neocortex. Nature 2001, 409(6821):714-720.
3.Nowakowski TJ, Bhaduri A, Pollen AA, Alvarado B, Mostajo-Radji MA, Di Lullo E, Haeussler M, Sandoval-Espinosa C, Liu SJ, Velmeshev D et al: Spatiotemporal gene expression trajectories reveal developmental hierarchies of the human cortex. Science 2017, 358(6368):1318-1323.
4.Liu DD, He JQ, Sinha R, Eastman AE, Toland AM, Morri M, Neff NF, Vogel H, Uchida N, Weissman IL: Purification and characterization of human neural stem and progenitor cells. Cell 2023, 186(6):1179-1194 e1115.
5.Sun Y, Goderie SK, Temple S: Asymmetric distribution of EGFR receptor during mitosis generates diverse CNS progenitor cells. Neuron 2005, 45(6):873-886.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


