Cell Stem Cell:曾艺/陈剑峰团队揭示乳腺干细胞与免疫微环境细胞相互作用新机制
来源:生物世界 2023-12-26 10:14
该研究揭示了干细胞为何具有更强的生存能力,为何具有化疗耐药性的分子机制,对开发靶向肿瘤干细胞治疗策略,具有潜在的重要意义
中国科学院大学杭州高等研究院曾艺教授团队在 Cell Stem Cell 期刊发表了题为:Niche inflammatory signals control oscillating mammary regeneration and protect stem cells from cytotoxic stress 的研究论文。
该研究发现了乳腺干细胞与免疫微环境细胞新的相互作用,揭示了乳腺干细胞具有更强的生存能力和化疗耐药性的分子机制。

曾艺实验室之前的研究鉴定了表达蛋白C受体(Procr)的乳腺多能干细胞(Procr+ MaSC),在谱系示踪实验中这类干细胞能够分化为基底细胞和管腔细胞,在移植实验中这类干细胞能够具有强大的重构器官的能力(Nature 2015)。另外, Procr+ MaSC缺失也会进一步导致乳腺导管的缺陷,这提示了其在发育和稳态维持中的重要作用(Cell Reports 2020)。
这项最新研究,首先发现了在生理周期中,由于乳腺组织的微环境中发生的细胞凋亡的增多和减少,会引起有节律地、反复地自限性炎症规律。通过单细胞转录组分析、体外共培养实验、体内谱系示踪实验和遗传学基因敲除实验,发现细胞凋亡引起组织驻留的CD11c+巨噬细胞的激活,分泌IL1β,激活Procr+ 干细胞的IL1R1-NF-κB信号通路活性。微环境中的细胞凋亡增多时,组织中的Procr+ 干细胞的NF-κB信号通路活性上调,一方面促进生存,另一方面抑制分化。相反,微环境中的细胞凋亡减少时,Procr+干细胞的NF-κB信号通路下调,干细胞启动分化程序,产生后代细胞,表现为产生更高比例的管腔细胞(管腔细胞在生理周期的形态变化中更容易发生凋亡和被损耗)。
在正常生理状态下,组织干细胞随着生理周期的节律进行周期性地NF-κB信号通路活性震荡,产生的后代细胞贡献于组织器官的稳态维持和再生。在病理状态下,例如在化疗药物紫杉醇使用时,组织中更多的细胞死亡,引起CD11c+ 巨噬细胞活动增加,其与Procr+ 干细胞的交流增强,赋予了干细胞更强的存活能力,即干细胞在细胞毒性应激条件下存活,表现为化疗耐药性。最后,使用小分子化合物抑制来IL1R1,可以阻断巨噬细胞与干细胞的互作,降低干细胞在应激条件下的NF-κB活性,提高了干细胞对紫杉醇治疗的敏感性。
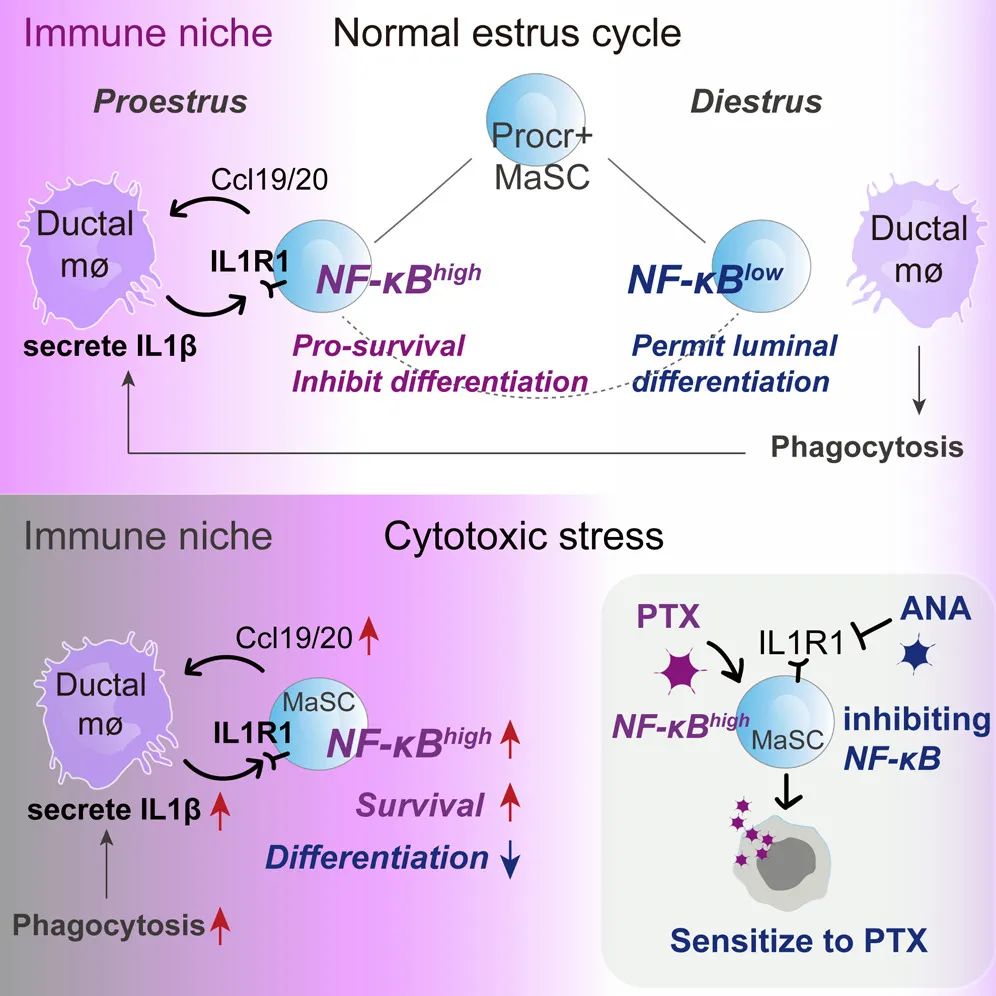
总的来说,该研究揭示了干细胞为何具有更强的生存能力,为何具有化疗耐药性的分子机制,对开发靶向肿瘤干细胞治疗策略,具有潜在的重要意义;发现了Procr+ 干细胞与免疫微环境细胞新的互作,并揭示了干细胞主动调控其免疫微环境的能力。
该研究由国科大杭州高等研究院-中国科学院上海分子细胞卓越创新中心曾艺研究组和陈剑峰研究组合作完成。国科大杭州高等研究院-中国科学院上海分子细胞科学卓越创新中心博士后刘春业为本文第一作者,曾艺研究员和陈剑峰研究员为该论文的共同通讯作者,该研究得到了多伦多大学许志忠教授的大力帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


