Nature:王斯瑶等揭示辐射损伤会通过父亲遗传给后代
来源:生物世界 2022-12-23 15:57
这一发现意味着即便在没有受到辐射的人体内,人类精子的DNA损伤仍会使用与线虫同样的DNA修复方式。这样形成的突变虽可能是物种遗传多样性的主要驱动因素,但同时也可能是导致人类遗传病的元凶。
众所周知,辐射(本文指电离辐射)所致的DNA损伤可以诱发诸如白血病在内的多种疾病,然而辐射所致的DNA损伤是否可以传递给后代却一直是困扰科学界的一大未解之谜。
尽管动物实验证明,辐射会导致后代出现更高的癌症风险和基因突变率, 但是大量人类相关的结果却与之相悖。
上世纪90年代,科学家发现英国Sellafield核电站附近村庄里的儿童白血病患病率比其他地区升高了10倍,英国南安普顿大学的 M J Gardner 博士由此提出假说——父亲在受孕前6个月内的辐射暴露会增加后代儿童白血病和淋巴癌的患病率【1】。然而之后开展的多项人类流行病学和遗传学研究却否定了这个假说。
基于这些研究结果,英国环境辐射医学问题委员会(COMARE)在2017 年年度报告中得出结论——父亲在受孕前期的辐射暴露并不会升高后代的患癌率【2】。
然而正如著名天文学家卡尔·萨根教授所言:Absence of Evidence does not mean Evidence of Absence(没有证据支持一个事物的存在,并不能由此论证这个事物的不存在),由于针对人类的辐射相关研究往往受限于样本量和记录的严谨性,因此想要得出明确的结论必须借助模式动物来对辐射损伤的遗传机制进行系统且细致的研究。
2022年12月22日,德国科隆衰老及衰老相关性疾病研究所(CECAD)及老龄化疾病基因组稳定性研究所(IGSAD)的王斯瑶博士(第一作者兼共同通讯作者)和 Björn Schumacher 教授(共同通讯作者)团队在 Nature 期刊发表了题为:Inheritance of paternal DNA damage by histone-mediated repair restriction 的研究论文。
该研究突破性地揭示了辐射所致DNA损伤的遗传机制:辐射所致的父系DNA损伤通过组蛋白介导的修复抑制来遗传给后代。

研究团队使用秀丽隐杆线虫(Caenorhabditis. elegans)作为模型,发现辐照雄性线虫(P0)会导致第三代线虫(F2 代)出现极高的死亡率,而这一现象在雌性线虫中并不存在(图1)。研究团队进而证明出雄性线虫的成熟精子才是导致辐射损伤遗传的罪魁祸首。他们发现成熟精子内的DNA损伤不能被修复从而被传递给后代;而与之相反,辐照后的卵子却呈现出两种不同的结局:要么准确地修复损伤,要么在损伤过于严重的情况下诱导细胞死亡,因此卵子的DNA损伤无法遗传下去。
那么为什么受精后的卵子无法修复受损的父系DNA呢?借助单线虫全基因组测序等技术,研究团队发现:当卵子与受损的精子结合后,卵子内的母体修复蛋白会试图修复父系DNA并使用了一种极易出错的修复机制(Theta-mediated end joining,TMEJ)将断裂的DNA片段随机融合;然而这些随机融合的片段却会改变染色体的原有结构,进而影响了第二代线虫(F1代)的基因组稳定性。
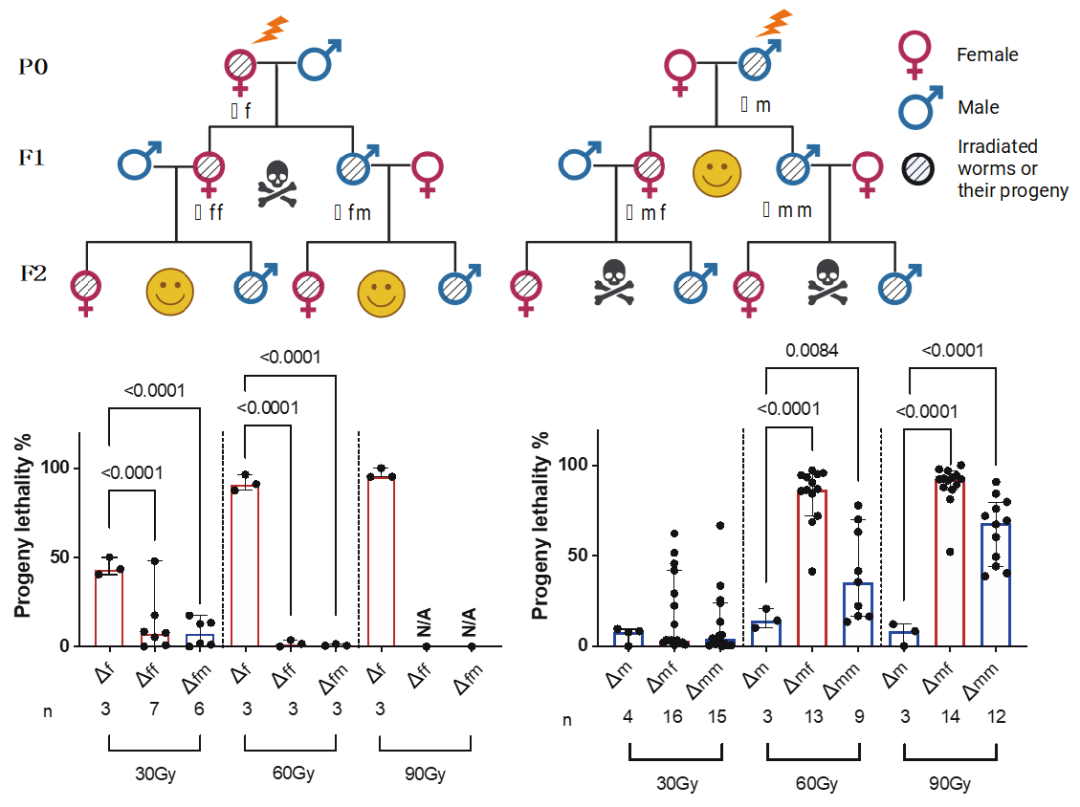
图1: 对雄性线虫的辐射损伤(Δm)造成第三代的高死亡率,而雌性线虫的辐射暴露(Δf)则不会
那么染色体的随机融合是如何导致第三代线虫(F2代)的先天缺陷呢?研究团队发现,随机融合后的染色体在F1代的体细胞和生殖细胞里会反复发生断裂,这些不断受损的染色体会被致密的组蛋白H1紧紧包裹起来,从而屏蔽了正确的DNA修复机制(homologous recombination repair,HRR)(图2)。
如果将包裹受损染色体的组蛋白H1或异染色质结合蛋白HPL-1移除,断裂的染色体就可以被正确的DNA修复蛋白所识别,继而产生健康的后代。鉴于组蛋白在物种之间的高度保守性,这一发现可以为人类的辐射损伤提供潜在的治疗方案。
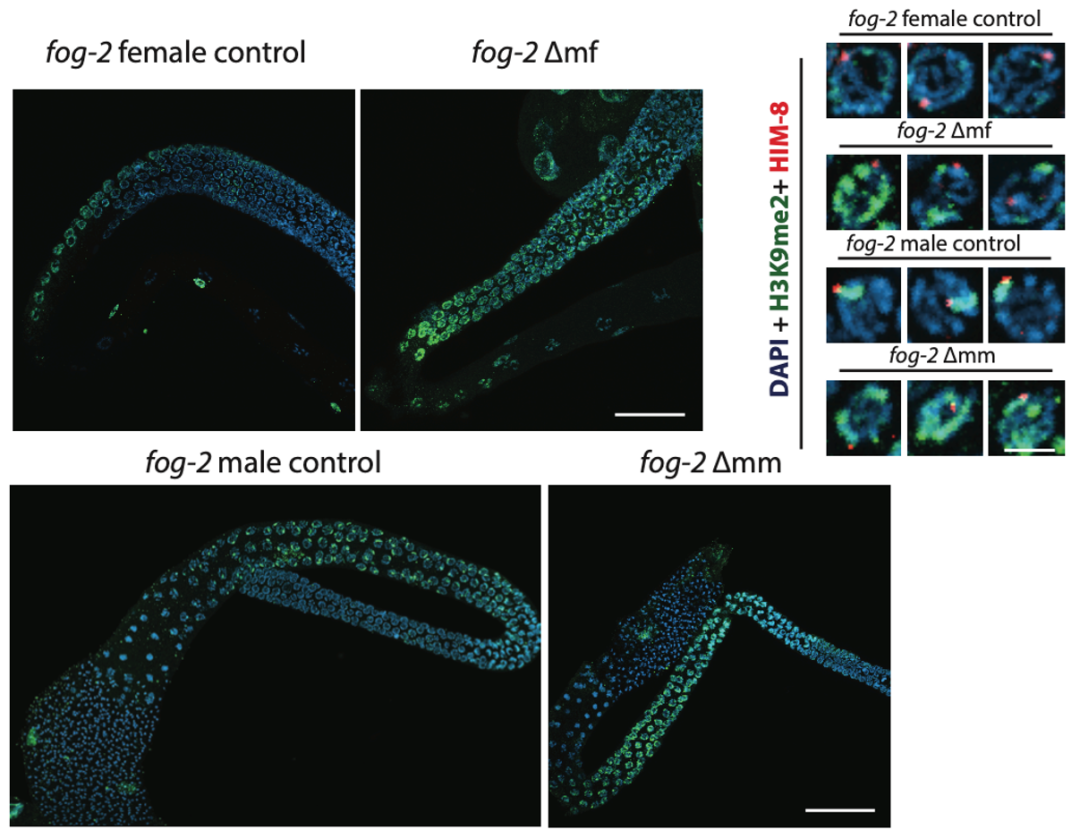
图2:辐照后第二代雌性(Δmf)和雄性(Δmm)的生殖细胞内出现了更多的异染色质结构 (绿色荧光显示了异染色质标记物H3K9me2,蓝色荧光为DNA)
父系DNA损伤也是导致生殖系统新发突变(de novo mutations,DNMs)的主要原因,来自父系的DNMs被认为与自闭症和精神分裂症等疾病相关联,同时也是维持遗传多样性和推动物种进化的主要动力。
除了在线虫上的工作,研究团队还通过对已发表的人类基因组数据库(1000 Genome Project)【3】进行分析后发现,在人类中检测到父系遗传的DNMs存在与线虫同样的TMEJ结构突变。
这一发现意味着即便在没有受到辐射的人体内,人类精子的DNA损伤仍会使用与线虫同样的DNA修复方式。这样形成的突变虽可能是物种遗传多样性的主要驱动因素,但同时也可能是导致人类遗传病的元凶。
这项研究提示了我们,应加强对男性,尤其是对备孕期男性辐射安全的重视度。考虑到后代潜在的健康风险,成熟精子需要被特别保护以免受到辐射损伤,而受损的精子也应避免用于人工受孕。精子DNA损伤所导致的遗传风险可能出现于放化疗期间,尤其是在新生精子尚未取代受损精子的两至三个月之内。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


