Nature子刊:报道脚手架蛋白相分离调控微生物细胞极性
来源:深圳先进院 2022-12-19 10:19
细胞不对称性(也称细胞极性)广泛存在于动植物和微生物细胞中,其基本特征是母细胞在分裂前发生细胞极化,从而不对称分裂生成两个不同命运的子代细胞。
细胞不对称性(也称细胞极性)广泛存在于动植物和微生物细胞中,其基本特征是母细胞在分裂前发生细胞极化,从而不对称分裂生成两个不同命运的子代细胞。细胞极性是生命世界产生多样性的根本原因,在细胞生长、增殖、分化、发育和行使细胞功能等方面发挥重要作用。细胞极性紊乱是某些肿瘤(如皮肤癌)发生的重要表现;微生物中,细胞极性会产生细胞异质性,造成病原菌抗性耐受(如结核分枝杆菌)、环境抵抗或宿主免疫逃逸等。
然而,由于细胞命运决定调控网络的高度复杂性,关于细胞极性的认知处于初级阶段。细胞命运决定蛋白如何实现时空有序的不对称性亚细胞定位,是该领域有待深入解析的核心问题。微生物新月柄杆菌作为细胞不对称性分裂的精炼模型,在细胞极性研究中具有独特优势。
近日,中国科学院深圳先进技术研究院赵国屏/赵维团队在《自然-通讯》上,发表了题为Phase separation modulates the assembly and dynamics of a polarity-related scaffold-signaling hub的研究成果。该研究发现脚手架蛋白通过相分离形成具有细胞命运决定功能的极性无膜区室,揭示了微生物细胞极性构建和动态调控的新机制。
脚手架蛋白广泛存在于细胞中,通常能自组装形成大分子复合物并将客户蛋白招募至特定的细胞区域,在信号转导、细胞分裂、形态发生和不对称分裂等生物过程中发挥作用。有研究发现,在果蝇和隐杆线虫中,Par蛋白可以通过相分离形成无膜区室,使下游信号蛋白(如αPKC或PKC3)不对称定位和分布,从而保证胚胎发育正常进行。这引起了科研团队对微生物脚手架蛋白可能通过发生相分离来调控细胞极性的思考。
研究团队以细胞发育模式微生物——新月柄杆菌为研究对象。在每个细胞周期中,新月柄杆菌可不对称性分裂产生一个带鞭毛的游动子细胞和一个有柄子细胞(图1)。在细胞分裂前,一对细胞命运决定蛋白(磷酸化酶PleC和蛋白激酶DivJ)的极性定位协同调节多个下游信号蛋白的磷酸化水平,并决定新月柄杆菌的细胞命运。已有研究表明,蛋白激酶DivJ通过PopZ和SpmX这一对脚手架蛋白复合物被招募到旧细胞极。而前期研究发现磷酸化酶PleC被一个潜在的脚手架蛋白PodJ定位到新细胞极。然而,微生物脚手架蛋白如何招募细胞命运决定因子进而调控细胞极性的作用机制尚不清楚。为此,该团队以PodJ蛋白为中心,在新月柄杆菌中开展了细胞极性建立和调控机制的研究。
科研人员通过活细胞延时摄影证实了PodJ的细胞极定位模式——PodJ特异性地识别并聚集在新月柄杆菌的细胞新极。同时,PodJ能够在“远亲”大肠杆菌中表达并进行细胞极性定位。研究分析蛋白聚态特征发现,该蛋白可以在体外自发形成大分子的高聚物。同时,PodJ在新月柄杆菌和大肠杆菌中的极性聚集均不依赖其他脚手架蛋白,表明该蛋白是一种能自组装的脚手架蛋白。
通过PodJ蛋白序列分析,研究预测PodJ具有典型的内在无序蛋白序列(Intrinsically Disordered Region,IDR)和串联重复序列,暗示了该蛋白发生相分离的潜在可能。进一步实验发现,内源生理蛋白水平的PodJ可在体外自发形成微米大小的球形液滴。同时,PodJ在细胞内也可形成具有典型流动性液滴性质的蛋白凝聚体,说明其在体内外均可发生相分离。
通过大肠杆菌异源共表达平台,研究团队在23个新月柄杆菌细胞周期或极性相关蛋白中筛选出两个新的被PodJ所招募的细胞信号蛋白,即纤毛蛋白CpaE和鞭毛蛋白FliG。新月柄杆菌的验证性实验表明,PodJ对PleC、CpaE和FliG等细胞信号功能蛋白的特异性招募均发生在细胞新极。这说明脚手架蛋白PodJ可能通过相分离实现细胞区室化,并招募细胞新极相关的信号功能蛋白。
进一步,科研团队对PodJ蛋白的结构和功能域进行深入挖掘和表征。研究发现,PodJ蛋白的IDR和CC4-6两个结构域都可以介导体外相分离发生。为了更好地剖析体内PodJ相分离的结构域,研究团队在大肠杆菌中表达多个PodJ蛋白变体,观察其在细胞内的蛋白定位和积累情况,并使用FRAP分析其流动性。结果显示,仅有CC4-6能够形成细胞区室化并展现出一定的流动性。这说明CC4-6或IDR均可在体外驱动PodJ相分离,而在细胞内,PodJ相分离可能依赖CC4-6和IDR共同发挥作用。研究通过在大肠杆菌中共表达信号功能蛋白和PodJ变体蛋白发现,IDR负责PleC和CpaE的招募,而CC4-6负责与FliG的相互作用。PodJ的体外相分离试验进一步证实了这一点。这说明PodJ驱动的细胞区室化可能直接介导了对细胞信号功能蛋白的招募,从而在细胞新极的组织和构建过程中发挥作用。
在真核细胞中,不对称分配复合物之间往往存在相互的抑制性调节,这对于细胞极性的稳态建立同样重要。研究推测,原核细胞中的细胞极性调控可能也存在类似机制。为此,研究团队在11个新月柄杆菌极性蛋白中筛选到一个细胞旧极脚手架蛋白SpmX,发现其调节了PodJ在大肠杆菌的极性积累。在新月柄杆菌中,SpmX的存在负调节了PodJ细胞区室化形成。研究进一步在体外进行分析发现,SpmX可以直接抑制PodJ液滴的形成,并可以覆盖在PodJ液滴的表面,从而抑制液滴的生长并加速液滴的老化,造成对PodJ凝聚体动力学和稳定性的损害。上述体外和体内观察结果表明,新月柄杆菌的新、旧细胞极重塑可能是由SpmX对PodJ相分离的抑制性调控作用所驱动。
该工作提出了新的微生物细胞极性构建和动态调控机制。这一机制涉及细菌新细胞极组装以及新、旧细胞极重塑(图5)。该研究阐述了天然蛋白通过相分离形成无膜区室的分子基础,解析了细胞区室化的生理功能及动态调节,证实了相分离作为组装微生物细胞极性枢纽和调节不对称细胞分裂的关键作用。通过对比原核和真核细胞,研究预测相分离可能作为一种通用的生物物理机制在细胞极性发育过程发挥调控作用。同时,对于相分离及其互作组分进行功能解析,有助于进一步人工设计、合成相关元件,并为人工无膜细胞器和单细胞生命从头合成的实现打下基础。
研究工作得到国家自然科学基金、国家重点研发计划、中科院战略性先导科技专项、广东省基础与应用基础研究基金委员会和深圳市合成生物学创新研究院的支持。
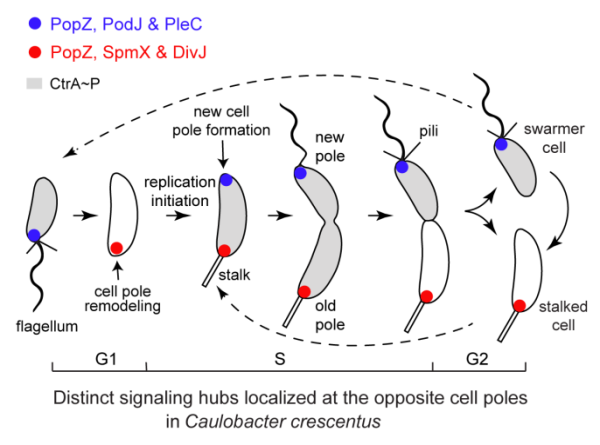
图1.新月柄杆菌细胞周期
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


