Nat Biomed Eng | 上海交通大学蔡宇伽等团队合作开发全新疫苗技术:树突状细胞靶向性类病毒颗粒,作为mRNA疫苗载体
来源:生物探索 2024-05-09 14:37
该研究报道了一种基于DCs靶向病毒样颗粒(DVLP)的mRNA疫苗技术。DVLP传递的抗原mRNA引发了强烈而持久的适应性免疫反应。
上海交通大学蔡宇伽及复旦大学洪佳旭共同通讯在Nature Biomedical Engineering 在线发表题为“Dendritic-cell-targeting virus-like particles as potent mRNA vaccine carriers”的研究论文,该研究报道了一种靶向DCs的病毒样颗粒的设计和性能,该颗粒具有工程化的Sindbis病毒糖蛋白,可识别DCs的表面蛋白,并包装编码严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)刺突蛋白或单纯疱疹病毒1的糖蛋白B和D的mRNA。
与非靶向病毒样颗粒和脂质纳米颗粒制剂相比,在小鼠足垫中注射靶向DCs的SARS-CoV-2 mRNA疫苗可导致更高且持久的抗原特异性免疫球蛋白-G滴度和细胞免疫反应。疫苗还保护小鼠免受SARS-CoV-2或单纯疱疹病毒1的感染。被树突状细胞优先摄取的病毒样颗粒可能有助于开发有效的预防性和治疗性疫苗。

疫苗是历史上最有效的医疗干预措施之一。据估计,它们每年在全球挽救250万人的生命。然而,许多疾病仍然没有有效的疫苗。事实上,目前还没有针对人类免疫缺陷病毒(HIV)、单纯疱疹病毒(HSV)-1和单纯疱疹病毒(HSV)- 2的预防性或治疗性疫苗。对于某些病毒,如乙型肝炎病毒和人乳头瘤病毒,现有的疫苗只是预防作用,不能消除既定的感染。针对非传染性疾病(如癌症)的疫苗开发仍处于早期阶段,在评估黑色素瘤和胶质母细胞瘤治疗的临床试验中取得了微小的成功。这些健康威胁促使进一步发展和改进疫苗技术。
针对2019冠状病毒病(COVID-19)的Moderna (mRNA-1273)和辉瑞/BioNTech (BNT162b2)疫苗的成功极大地推动了信使RNA疫苗的发展。由于mRNA易被核酸酶降解,不能自行进入细胞,因此人们开发了多种mRNA载体转移,包括脂质纳米颗粒(LNPs)、聚合物、多肽、病毒样复制子颗粒和树突状细胞(DCs)。LNPs现在是最受青睐的载体;然而,目前批准的LNP-mRNA疫苗不是细胞特异性的,可以被注射部位附近或远处的几乎任何细胞类型吸收,包括肝细胞。尽管针对严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)的mRNA疫苗可有效预防COVID-19的严重后果,但它们并不能完全控制病毒传播。此外,mRNA疫苗在SARS-CoV-2感染之外的潜力有待进一步探索。
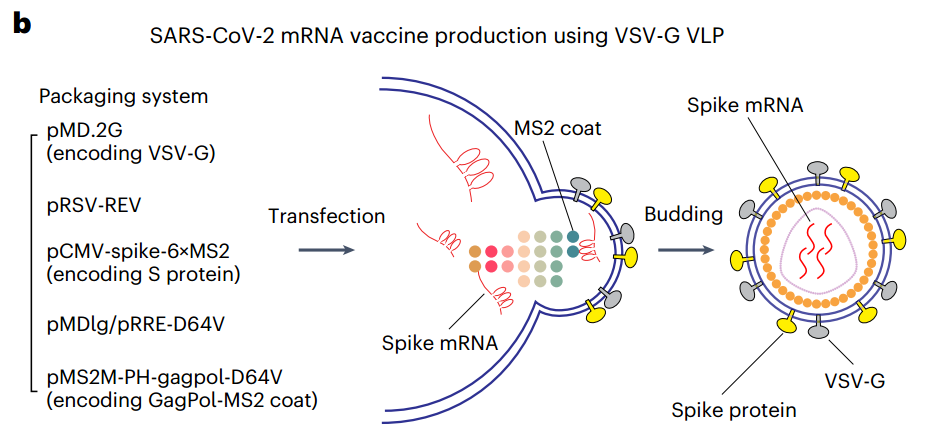
VLP技术生产SARS-CoV-2疫苗的示意图(Credit: Nature Biomedical Engineering)
DCs是主要的抗原呈递细胞(APCs),对疫苗的功能至关重要,它通过抗原加工和呈递到T细胞,以及通过加工抗原并呈递到B细胞诱导抗体反应来激发T细胞免疫反应。基于DCs的Provenge疫苗已被美国食品和药物管理局批准用于治疗前列腺癌;然而,它是通过激活从患者身上分离的APCs在体外生产的,而且其生产是劳动密集型的,这限制了它在更广泛人群中的可用性。此外,非专业APCs翻译抗原mRNA可能成为细胞毒性T淋巴细胞(CD8+ T细胞)介导的杀伤的靶标,这与“COVID臂”有关,这是一些患者在接受mRNA1273 SARS-CoV-2疫苗后出现的一种情况。此外,抗体依赖性细胞毒性可能破坏插入或分泌抗原蛋白并与质膜相关的细胞。
因此,原位靶向DCs是下一代mRNA疫苗的发展方向。这将简化生产过程,降低成本,提高疫苗的安全性。DCs特异性细胞间粘附分子3-grab non-integrin (DC-SIGN)是DCs的模式识别受体和粘附受体。它在DC迁移和粘附、炎症反应、T细胞激活和免疫反应的启动中起重要作用。与非特异性慢病毒载体相比,以Sindbis病毒糖蛋白为DC-SIGN配体的假型重组慢病毒载体表现出潜在的改进性能;然而,插入性突变的风险是限制其临床应用的一个因素。尽管LNPs已与特异性抗体或配体偶联以获得DC特异性,但基于LNPs的DC靶向mRNA疫苗的有效性证据仍然很少。
该研究报道了一种基于DCs靶向病毒样颗粒(DVLP)的mRNA疫苗技术。DVLP传递的抗原mRNA引发了强烈而持久的适应性免疫反应。研究发现,与非特异性病毒样颗粒(VLPs)和LNPs相比,DVLP引发了更大的抗原特异性免疫球蛋白G (IgG)反应和T细胞反应。重要的是,在SARS-CoV-2和HSV-1感染模型中,基于DVLP的mRNA疫苗分别在攻毒后3天和6天有效地保护小鼠免受活病毒感染。综上所述,该研究发现DVLP可以将抗原mRNA特异性地传递到DCs并引起增强的免疫力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


