Nature子刊:高通量LNP筛选系统,成功开发肺靶向的新型LNP
来源:生物世界 2024-03-08 09:40
这项概念验证研究表明,高通量条形码技术可以作为LNP筛选工具,用于识别结构独特的纳米颗粒,用于肝外向肺部递送mRNA。
宾夕法尼亚大学 Michael Mitchell 团队(Lulu Xue为第一作者)在 Nature Communications 上发表了题为:High-throughput barcoding of nanoparticles identifies cationic, degradable lipid-like materials for mRNA delivery to the lungs in female preclinical models 的研究论文。
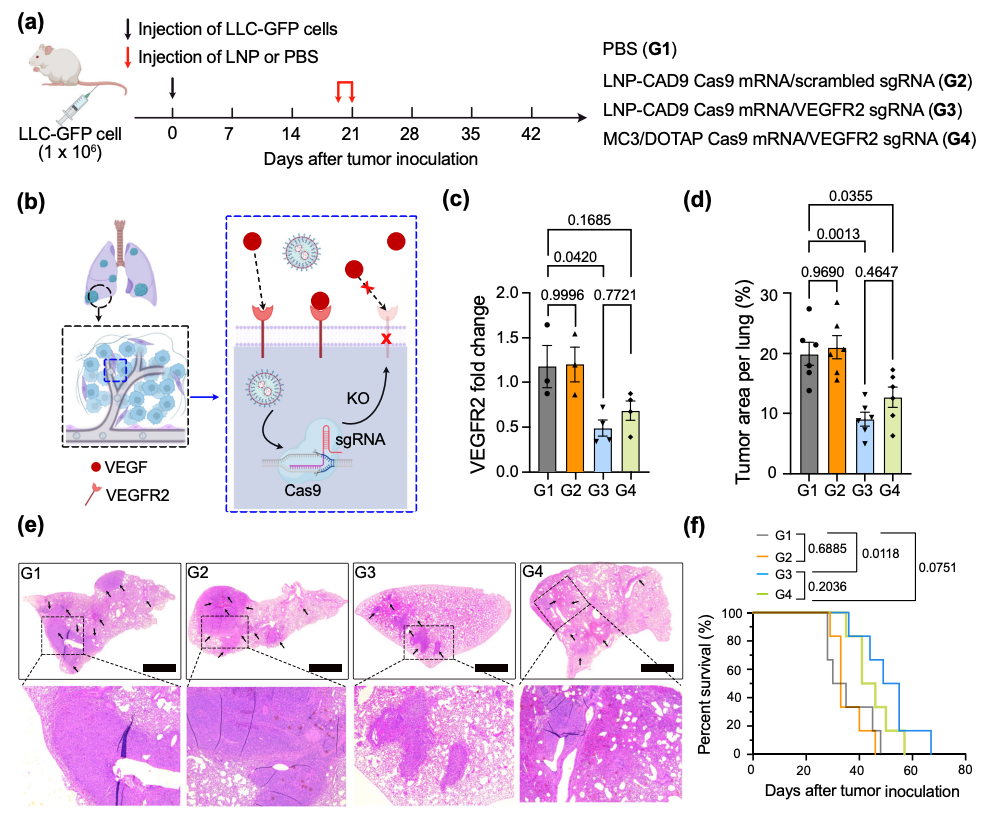
该研究开发了一种基于条形码DNA(b-DNA)的高通量LNP筛选系统,可在单个动物中研究多种纳米颗粒,以探索组合阳离子可降解(CAD)脂质库,并发现了一种在体内向肺部递送mRNA的最佳LNP——LNP-CAD9,其在系统给药时成功将CRISPR-Cas9系统递送到小鼠肺内皮细胞并敲除了VEGFR2基因,抑制了肺肿瘤模型中血管生成,进而抑制肿瘤生长。
该研究开发的高通量LNP筛选系统具有快速、低成本和高效率的优点,有助于加速肝脏以外的mRNA疗法的开发。

由于肺相关疾病中内皮细胞、上皮细胞和免疫细胞的病理靶点的多样性,肺部是mRNA递送的引人注目的靶标。各种方法已被用于靶向肺部及其相应的细胞群,虽然其中一些方法已经在1/2期临床研究中取得了进展,但多步策略和安全问题限制了它们在评估大型脂质库中的适用性。
之前的研究表明,阳离子脂质更有可能成功地将有效载荷递送到肺组织。然而,商业化的阳离子脂质通常带高正电荷且有毒。为了在每个大型、化学上不同的脂质库中识别在mRNA递送中表现更好的阳离子脂质,科学家们必须探索每个脂质体配方在体内将有效载荷递送到目标组织和细胞中的效率。由于每个脂质库需要注射和牺牲数千只小鼠,因此通常只有一小部分的LNP候选物可以在体内进行评估,这限制了原始大脂质库剩余部分的数据可用量。此外,还有指出,体外递送谱通常不能很好地预测体内纳米颗粒的递送。
因此,开发高通量方法进行体内筛选可以加速发现具有化学结构和特性的LNP,这些LNP可以克服在肺部基因治疗应用中的递送障碍。
在这项研究中,研究团队采用基于条形码DNA(b-DNA)的高通量LNP筛选系统,可在单个动物中研究多种纳米颗粒,以探索组合阳离子可降解(CAD)脂质库,评估可电离化脂质化学结构-活性关系,用于肺部递送给药。
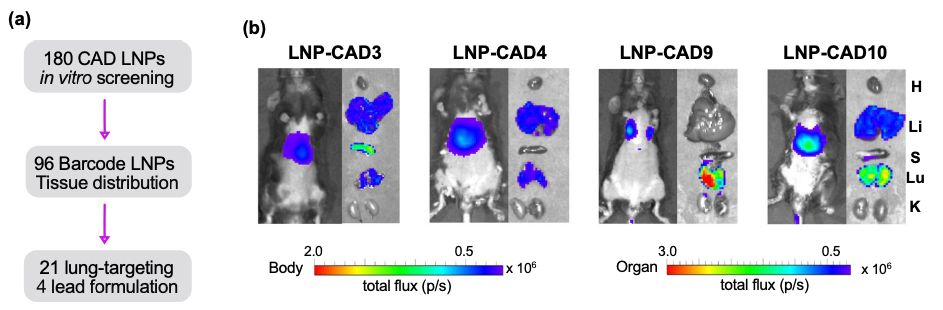
研究团队最初制备了180个含有编码萤火虫荧光素酶(FLuc)mRNA的CAD LNP,通过体外高通量筛选研究其递送潜力。然后选择了96个CAD LNP来封装b-DNA和FLuc mRNA,将LNP配方合并,并系统性给药到小鼠。然后提取DNA,通过深度测序量化向不同器官(心脏、肝脏、脾脏、肺和肾脏)的递送和积累,确定了21个有前途的肺部递送候选LNP。研究团队进一步在小鼠中反筛选了前4个含有FLuc mRNA的LNP,以评估其在肺部的mRNA递送效率。
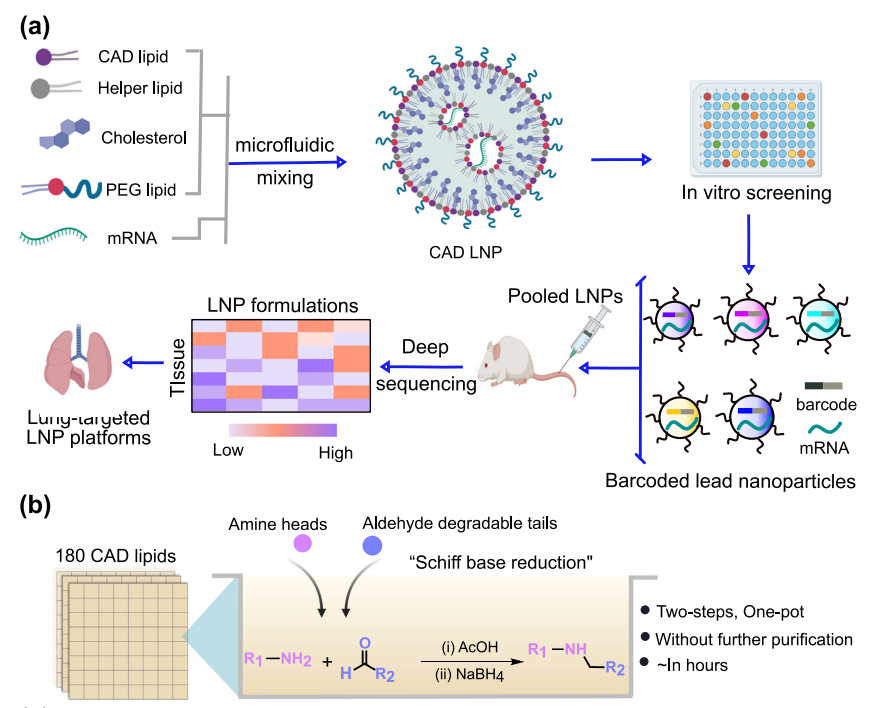
该研究确定LNP-CAD9是在体内向肺部递送FLuc mRNA的最佳LNP,其递送的荧光素酶优先在肺部表达(约占总发光通量的90%)。此外,LNP-CAD9递送Cas9 mRNA和靶向VEGFR2的sgRNA,在4.0 mg/kg的剂量下有效诱导小鼠肺内皮细胞的VEGFR2基因敲除,从而在肺肿瘤模型中表现出显著的抗血管生成治疗潜力,以抑制肿瘤生长,优于金标准的肺趋向性MC3/DOTAP LNP系统。
这项概念验证研究表明,高通量条形码技术可以作为LNP筛选工具,用于识别结构独特的纳米颗粒,用于肝外向肺部递送mRNA。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


