Cell:单胚胎蛋白质组学突破——助力不孕不育诊断与个性化治疗
来源:生物探索 2025-02-02 09:34
运用超灵敏蛋白质组学(ultrasensitive proteomics)技术,对人类卵母细胞及早期胚胎的蛋白质谱进行了系统解析,检测到了近8000种蛋白,并揭示了这些蛋白在不同发育阶段的变化模式。
我们生命的起点,始于精子与卵子结合形成受精卵(zygote),随后在短短几天内经历一系列精密调控的分裂与分化,最终发展成具有多种细胞类型的囊胚(blastocyst),为胚胎成功植入子宫做好准备。然而,即便在最理想的生殖条件下,仍有大量受精卵无法完成这一过程,导致胚胎发育失败甚至不孕症的发生。这一问题不仅困扰着全球数百万试管婴儿(IVF)患者,同时也是生殖医学和胚胎学领域的重大科学难题。是什么因素决定了胚胎的命运?如何精准预测哪些胚胎能够顺利发育,而哪些胚胎可能会停滞或失败?
近年来,随着单细胞蛋白质组学(single-cell proteomics, SCP)技术的快速发展,研究人员得以以前所未有的分辨率探索胚胎发育过程中的蛋白动态变化。1月23日Cell的研究报道“Comparative proteomic landscapes elucidate human preimplantation development and failure”,运用超灵敏蛋白质组学(ultrasensitive proteomics)技术,对人类卵母细胞及早期胚胎的蛋白质谱进行了系统解析,检测到了近8000种蛋白,并揭示了这些蛋白在不同发育阶段的变化模式。研究还结合转录组(transcriptomics)和翻译组(translatomics)数据,发现蛋白合成的调控远比传统认为的更加复杂,尤其是在合子基因组激活(Zygotic Genome Activation, ZGA)前后的蛋白积累模式存在显著的物种差异。
此外,研究团队对超过100对患者夫妇的低质量胚胎(poor-quality embryos, PQ) 进行了单胚胎蛋白质组分析(single-embryo proteomics, SEP),成功识别出与发育失败相关的关键蛋白。这一突破性的研究不仅为生殖医学提供了新的诊断指标,还可能为未来的个性化胚胎筛选技术提供科学依据。随着蛋白质组学的深入应用,我们正在逐步揭示胚胎生命起源的神秘密码,为提高辅助生殖技术的成功率、解决不孕不育问题以及理解人类发育疾病带来前所未有的希望。

从受精到植入——人类生命的第一步
生命的旅程始于精子与卵子的结合,这一过程不仅仅是单纯的物理融合,而是一场复杂而精密的分子级调控。从受精到囊胚形成,胚胎经历多个关键的细胞分裂和分化阶段,而其中的每一步都可能决定它最终能否成功植入子宫,发育成为健康的胎儿。
人类胚胎发育的早期阶段包括受精卵(zygote)、2细胞期、4细胞期、8细胞期、桑葚胚(morula)和囊胚(blastocyst)。在这些过程中,最重要的生物学事件之一是合子基因组激活(Zygotic Genome Activation, ZGA),即胚胎从依赖母体提供的RNA和蛋白质,转变为自身启动基因表达的关键时刻。研究发现,人类胚胎的ZGA发生在8细胞期,而小鼠胚胎的ZGA则在2细胞期,这一物种差异可能影响胚胎的发育调控机制。该研究检测了超过8000种蛋白,描绘出胚胎在各个阶段的蛋白质组变化,为揭示ZGA及其对后续发育的影响提供了新的视角。
此外,蛋白质不仅仅是胚胎发育的“建筑材料”,更是执行各种生物功能的分子机器。例如,该研究发现,在囊胚阶段显著富集的CDX2蛋白,正是决定滋养层(trophectoderm, TE)命运的关键转录因子(transcription factor),而滋养层将最终发育成胎盘。这一发现表明,蛋白质的表达并非简单地随着基因转录而即时变化,而是受到更复杂的翻译调控和稳定性影响。
胚胎发育失败的困境:不孕症与试管婴儿挑战
尽管人类胚胎的发育过程经过了数百万年的进化优化,但其成功率却远低于人们的直觉。在自然受孕过程中,仅有30%-50%的受精卵能够成功发育至囊胚阶段,并最终植入子宫。而对于接受试管婴儿(In Vitro Fertilization, IVF)的夫妇来说,这一比例甚至更低。研究显示,在IVF过程中,大约12%-15%的胚胎会因“低质量”(poor-quality, PQ)而被淘汰,而这些低质量胚胎往往表现出碎片化、细胞不对称、发育迟缓等特征。
导致胚胎发育失败的因素复杂多样,既包括遗传突变,也涉及蛋白质稳态(proteostasis)的异常。该研究通过单胚胎蛋白质组学(single-embryo proteomics, SEP)分析了超过100对患者夫妇的低质量胚胎,发现了一组可能导致胚胎发育失败的关键蛋白。TPRX1蛋白在低质量胚胎中的表达明显受损,这可能意味着ZGA未能正常启动,导致胚胎无法进行后续的细胞分化。另一方面,KIFC1(动力蛋白家族成员)在部分低质量胚胎中表达显著下降,而该蛋白在其他哺乳动物的卵母细胞中已被证实与纺锤体稳定性相关,其缺失可能影响染色体分离,从而增加胚胎异常的风险。
现代蛋白质组学如何揭示胚胎发育的奥秘?
在过去,胚胎研究主要依赖基因组测序(genomics)和转录组学(transcriptomics)技术来解析其发育过程,但这些方法存在一个根本问题——它们只能告诉我们基因是否被转录,无法揭示蛋白质是否真正执行了功能。近年来,单细胞蛋白质组学(single-cell proteomics, SCP)的崛起为研究胚胎发育提供了新的视角。
该研究采用超灵敏蛋白质组学(ultrasensitive proteomics, CS-UPT2),成功解析了人类卵母细胞及早期胚胎的蛋白质组。研究发现,许多蛋白的翻译并不是线性同步于mRNA的表达,例如某些ZGA基因在mRNA水平上的表达高峰出现在8细胞期,但其对应的蛋白却在囊胚阶段才大量积累。这一发现颠覆了传统认为的“mRNA即蛋白”假设,表明蛋白的翻译和降解受到精细调控,可能决定了胚胎细胞命运。
此外,通过对低质量胚胎的蛋白质组学分析,研究团队发现了一组在低质量胚胎中特异性上调的蛋白,例如NCOA3(核受体共激活因子3),该蛋白在所有低质量胚胎中均显著上调,而其在正常胚胎中的表达水平则较低。这一现象提示,NCOA3可能是低质量胚胎的潜在生物标志物,未来或可用于IVF中的胚胎筛选。
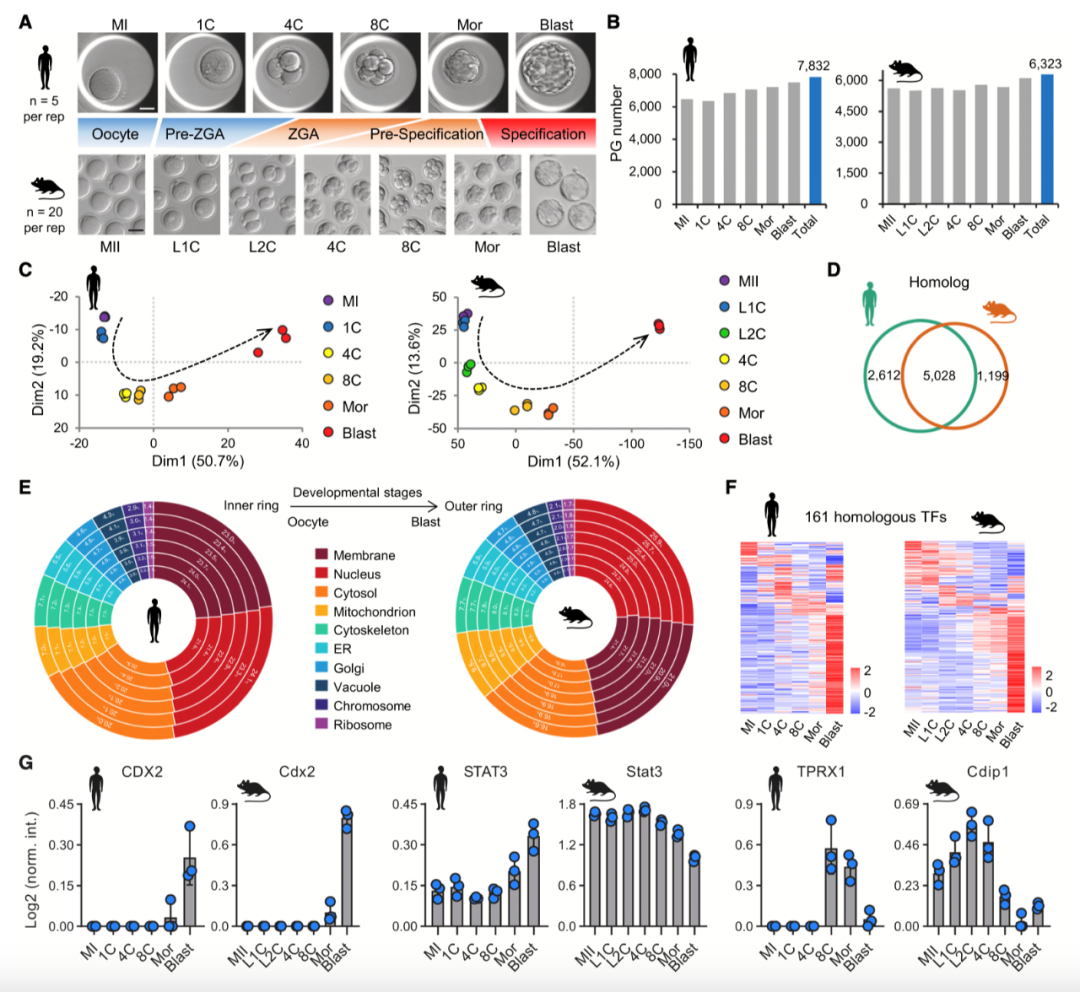
人和小鼠植入前胚胎发育的蛋白质组学景观(Credit: Cell)
(A) 人和小鼠卵母细胞及胚胎各阶段的实验设计
该部分展示了用于质谱分析(MS)的卵母细胞和胚胎样本,并将人类和小鼠在相应发育阶段的对照关系进行了匹配。例如:卵母细胞(Oocytes),受精卵(Zygote),早期卵裂期(2细胞、4细胞、8细胞),桑葚胚(Morula),囊胚(Blastocyst)。
尽管人类和小鼠的胚胎发育速度和基因组激活(ZGA)时机存在差异,但此图明确展示了两者在形态和分子事件上的对应关系。
(B) 人与小鼠胚胎不同阶段鉴定到的蛋白数量
该部分统计了蛋白组(Proteome Groups, PGs)的数量,反映了不同发育阶段的蛋白质表达情况:在卵母细胞和早期胚胎阶段,蛋白种类相对较少,主要依赖母源蛋白支持发育。囊胚阶段蛋白种类显著增加,表明随着基因组激活(ZGA)的发生,胚胎自主蛋白合成能力增强。同时,比较了人类和小鼠在不同阶段的蛋白数量,揭示了物种间的相似性与差异。
(C) 人和小鼠胚胎蛋白质组数据的主成分分析(PCA)
PCA(主成分分析)用于可视化不同发育阶段样本的蛋白质组数据分布:同一物种的不同胚胎阶段形成清晰的轨迹,表明蛋白质表达随着发育阶段的推进呈现特定模式。人类和小鼠的蛋白质表达模式存在一定重叠,但仍保持物种特异性,这可能与不同的发育机制和调控策略相关。
(D) 人和小鼠胚胎蛋白的同源性分析(Venn 图)
Venn 图展示了人类和小鼠在胚胎发育过程中表达的蛋白之间的重叠情况:部分蛋白在两种生物中高度保守,表明这些蛋白在胚胎发育过程中起到核心作用。也有许多蛋白是物种特异性的,这可能解释了人类和小鼠在胚胎发育机制上的差异,例如基因组激活(ZGA)发生的时机不同。
(E) 主要亚细胞定位蛋白的分布(甜甜圈图)
此部分展示了在不同发育阶段和不同物种中,蛋白的亚细胞定位分布:前十大亚细胞结构(如细胞核、细胞质、线粒体等)在各阶段蛋白表达中的比例。蛋白分布的动态变化反映了发育过程中细胞功能的调整,例如囊胚阶段线粒体相关蛋白的增加,提示能量需求的提升。
(F) 同源转录因子(TFs)在发育过程中的动态变化(热图)
该部分分析了人和小鼠胚胎发育过程中转录因子(TFs)的蛋白表达模式:关键转录因子在不同阶段的表达变化,如调控合子基因组激活(ZGA)、细胞分化和滋养层发育的转录因子。不同物种间的转录因子表达模式比较,揭示了人类和小鼠在基因调控上的异同点。
(G) 关键蛋白的动态变化
该部分展示了几个在胚胎发育过程中重要的蛋白的表达趋势:蛋白表达水平的动态变化趋势(包括均值±标准差,SD),说明某些蛋白在特定阶段显著上调或下调。不同发育阶段的关键蛋白可能与细胞周期调控、基因组激活、能量代谢等核心生物学事件相关。
从卵母细胞到囊胚:8000种蛋白的动态变化
我们生命的起点从单个受精卵开始,这一小小的细胞在短短几天内经历快速分裂和复杂的分子调控,最终形成囊胚(blastocyst)。在此过程中,蛋白质不仅是构成细胞结构的基本单位,更是调控细胞分裂、基因表达、能量代谢和信号传导的核心分子。
为了深入解析人类胚胎发育的分子机制,该研究利用超灵敏蛋白质组学(ultrasensitive proteomics)技术,在单胚胎水平上检测了近8000种蛋白,并详细刻画了从卵母细胞(oocyte)到囊胚的蛋白质组变化轨迹。研究发现,不同阶段的胚胎在蛋白表达上呈现出高度的动态性,其中一些蛋白的激活或抑制与胚胎的发育成败密切相关。
从整体数据来看,研究团队将早期胚胎的蛋白表达模式分为三类:
母源储备蛋白(Maternal stock proteins):这些蛋白由卵母细胞合成并储存,在受精后支持胚胎的最初发育。例如,YBX1(mRNA稳定蛋白)在受精卵阶段高表达,但随着发育推进逐渐降解,以便为新合成的胚胎蛋白腾出空间。
逐步增加的胚胎特异性蛋白(Gradually increasing embryonic proteins):如NPM2(核仁蛋白2),其在合子基因组激活(ZGA)前处于低表达状态,但在8细胞期后逐步积累,提示其在调控ZGA过程中可能具有关键作用。
快速上调的囊胚期蛋白(Blastocyst-stage rapid upregulated proteins):如CDX2(滋养层分化关键转录因子),其在囊胚阶段显著增加,决定了滋养层(trophectoderm)细胞的命运,并最终促进胎盘的发育。
通过这一蛋白质组全景图,研究人员不仅识别了胚胎发育各阶段的关键蛋白,还发现了一些可能影响胚胎存活率的新分子靶标,为生殖医学领域的精准筛选提供了科学依据。
关键蛋白的动态变化:哪些蛋白决定了胚胎的存活与发育?
胚胎发育是一个由蛋白质精确调控的复杂过程,而不同阶段的关键蛋白则决定了胚胎能否成功发育至囊胚阶段。该研究的蛋白质组分析揭示了几个对胚胎存活至关重要的蛋白:
DDX6(RNA解旋酶)——调控母源mRNA降解,确保ZGA顺利启动
研究发现,DDX6在受精卵中表达较高,并在ZGA前迅速下降。这一现象表明,该蛋白可能通过调控母源mRNA的降解,确保胚胎能在合适的时间点开始自主基因表达。低质量胚胎(PQ embryos)中DDX6的降解延迟,可能导致母源mRNA过度积累,从而干扰胚胎的正常发育。
KIFC1(染色体分离动力蛋白)——维持有丝分裂稳定性,防止染色体异常
KIFC1在8细胞期开始上调,并在囊胚阶段保持高水平表达。该蛋白对于纺锤体的稳定性至关重要,确保染色体正确分配。低质量胚胎中,KIFC1表达不足,导致染色体错误分离,从而增加发育异常的风险。
NCOA3(核受体共激活因子3)——过度表达可能与胚胎质量下降有关
研究发现,在低质量胚胎中,NCOA3的表达水平显著高于正常胚胎。尽管其具体功能仍需进一步研究,但已有证据表明,该蛋白可能与细胞信号失衡和代谢紊乱有关,成为潜在的负向生物标志物。
这些关键蛋白的表达变化,为研究胚胎存活率和质量提供了新的分子线索,未来或可用于胚胎筛选和质量评估。
蛋白翻译与积累的时间差异:合子基因组激活(ZGA)的调控模式
ZGA是胚胎发育过程中最重要的转折点之一,它标志着胚胎从依赖母源RNA转变为自身基因表达的阶段。该研究通过结合转录组(mRNA表达)和蛋白质组(蛋白表达)数据,发现ZGA相关基因的mRNA和蛋白表达之间存在明显的时间差异,这对传统的基因表达理论提出了挑战。
某些mRNA早早合成,但蛋白滞后表达
例如,TUBA1B(α-微管蛋白)的mRNA在8细胞期大量合成,但其蛋白水平却直到囊胚阶段才开始显著上升。这表明胚胎并非立即翻译所有新合成的mRNA,而是通过翻译调控和蛋白降解机制,确保在正确的时间点合成关键蛋白。
某些蛋白快速积累,而mRNA表达相对较低
例如,HSP90(热休克蛋白)在囊胚期蛋白水平显著提高,但其mRNA在ZGA阶段并没有明显增加。这说明某些蛋白的稳定性较高,即便mRNA水平较低,蛋白仍然可以累积并维持功能。
低质量胚胎中的ZGA异常
研究发现,在低质量胚胎中,多个ZGA相关蛋白的翻译效率受损。例如,PRDX1(过氧化物还原酶1)的mRNA在正常胚胎和低质量胚胎中表达相似,但其蛋白水平在低质量胚胎中显著降低。这一现象提示,ZGA阶段的蛋白翻译障碍可能是导致胚胎发育失败的重要因素。
这些发现挑战了传统“mRNA即蛋白”的观念,表明胚胎发育不仅依赖基因转录,还受蛋白翻译和降解的精细调控。
为什么有些受精卵无法发育成健康胚胎?
受精卵的形成标志着新生命的开始,但并非所有受精卵都能成功发育成健康的胚胎。事实上,在自然受孕和试管婴儿(IVF)过程中,胚胎的发育失败率远高于人们的想象。导致胚胎发育受阻的原因多种多样,包括基因突变、染色体异常、能量代谢失衡、蛋白质稳态破坏等。该研究通过单胚胎蛋白质组学(single-embryo proteomics, SEP)分析了超过100对患者夫妇的低质量胚胎(poor-quality embryos, PQ),揭示了与胚胎发育失败相关的关键蛋白,为探索胚胎质量下降的机制提供了新的视角。
胚胎发育失败的原因:基因突变 vs. 代谢异常
影响胚胎发育的核心因素可大致分为两类:基因层面的异常(遗传因素)和生理代谢层面的异常(环境因素)。
1. 基因突变与染色体异常
研究表明,大约50%-70%早期流产的胚胎存在染色体异常,其中包括三体(Trisomy)、单体(Monosomy)和嵌合体(Mosaicism)等问题。
在该研究的低质量胚胎蛋白质组数据中,研究人员发现,与染色体分离相关的KIFC1(染色体分裂动力蛋白)在部分低质量胚胎中表达异常,可能导致染色体错误分配,最终影响胚胎的生长潜力。
TPRX1(一种调控ZGA启动的蛋白)在部分低质量胚胎中未能有效表达,这可能阻碍了胚胎自主基因表达的开启,使其停滞在早期阶段。
2. 代谢异常对胚胎质量的影响
受精卵发育的核心能量来源是线粒体(mitochondria)。研究发现,在低质量胚胎中,ATP合成相关蛋白(如ATP5A1、NDUFA9)的表达显著降低,提示这些胚胎可能因能量供应不足而无法正常生长。
氧化应激(oxidative stress)也是胚胎发育失败的重要因素。该研究发现,过氧化物还原酶1(PRDX1)在低质量胚胎中的表达水平较低,而该蛋白正是细胞抵抗氧化应激的关键因子。这可能导致低质量胚胎更容易受到环境损伤,增加发育停滞的可能性。
总体来看,低质量胚胎的失败并非单一因素所致,而是基因调控异常、细胞能量代谢紊乱和胚胎内环境失衡的共同结果。
低质量胚胎(PQ embryos)的蛋白质组学特征
为了深入理解胚胎发育失败的机制,研究团队对正常囊胚和低质量胚胎的蛋白质表达模式进行了系统性比较,并发现了多个显著差异表达的蛋白。其中,部分蛋白可能是低质量胚胎的特征性分子标志物。
1. 低质量胚胎中异常上调的蛋白
NCOA3(核受体共激活因子3):该蛋白在低质量胚胎中高表达,可能导致细胞信号紊乱,并影响胚胎的正常发育。
HSP90(热休克蛋白90):该蛋白的异常表达可能与胚胎应激反应增强有关。
2. 低质量胚胎中表达下降的蛋白
DDX6(RNA解旋酶):负责降解母源mRNA,确保胚胎自主基因表达的顺利启动。在低质量胚胎中,其降解效率下降,可能导致母源基因调控的延迟。
KIFC1(微管动力蛋白):负责染色体分离和细胞分裂,表达减少可能增加染色体异常的风险。
这些蛋白的异常表达,为理解低质量胚胎的生物学特征提供了新的视角,也为未来的胚胎质量评估和筛选提供了潜在的生物标志物。
发现影响胚胎质量的关键蛋白:哪些蛋白是“好胚胎”的标志?
研究不仅关注低质量胚胎的异常蛋白,还发现了一些在高质量胚胎(good-quality embryos)中富集的蛋白,它们可能成为未来评估胚胎发育潜力的重要指标。
1. 高质量胚胎中特异性高表达的蛋白
CDX2(滋养层细胞分化关键蛋白):在高质量胚胎中表达显著上调,决定胚胎植入能力。
NPM2(核仁蛋白2):在ZGA后期上调,可能与胚胎细胞增殖和DNA稳定性相关。
ATP5A1(线粒体ATP合成酶亚基):高表达提示能量代谢活跃,有助于胚胎正常发育。
2. “好胚胎”的代谢优势
高质量胚胎中,线粒体相关蛋白(如NDUFA9、COX5B)的表达普遍高于低质量胚胎,提示健康胚胎的能量代谢更加高效。
氧化应激防御能力更强,如PRDX1和GPX4(谷胱甘肽过氧化物酶4)的表达在高质量胚胎中更为稳定,说明其更能抵抗环境压力。
这些研究结果不仅帮助识别了影响胚胎质量的关键蛋白,也为未来基于蛋白质组学的精准胚胎筛选提供了可能性。例如,在试管婴儿治疗中,可以通过分析CDX2和ATP5A1等蛋白的表达水平,选择更具发育潜力的胚胎,从而提高胚胎移植的成功率。
未来:蛋白质组学能否帮助解决不孕不育?
不孕不育已经成为全球范围内影响生育率的重要问题。据统计,全球约有 10%-15% 的育龄夫妇面临生育困难,而在接受试管婴儿(IVF)治疗的患者中,仍有相当比例因胚胎质量不佳或胚胎植入失败而未能成功怀孕。尽管辅助生殖技术(ART)在过去几十年取得了显著进展,但如何进一步提高成功率、优化胚胎筛选和改善卵母细胞质量仍然是当前生殖医学的核心挑战。
该研究通过单胚胎蛋白质组学(single-embryo proteomics, SEP)深入分析了人类胚胎的蛋白质动态变化,并提出了一系列与胚胎发育质量相关的关键蛋白。此外,研究还揭示了影响卵母细胞(oocyte)质量的分子机制,为未来生殖医学的精准干预提供了新的思路。
除了胚胎筛选,蛋白质组学还能做什么?
蛋白质组学可以为不孕不育的诊断、治疗以及生殖技术优化提供更深入的分子机制解析。
1. 诊断不孕不育的潜在分子机制
传统的不孕不育诊断主要基于激素检测、染色体分析、宫腔镜检查等,但这些手段无法提供细胞和分子水平的动态信息。
该研究发现,低质量胚胎(PQ embryos)与高质量胚胎(GQ embryos)在蛋白表达上的显著差异,这些蛋白不仅影响胚胎发育,还可能与母体因素(如卵巢功能下降、激素失衡等)密切相关。例如,研究发现线粒体ATP合成酶(ATP5A1)和抗氧化蛋白PRDX1的表达水平可用于预测胚胎活力,而这些蛋白的异常也可能反映出母体卵母细胞的功能下降。
2. 开发个性化辅助生殖治疗策略
既然蛋白质是生物功能的直接执行者,研究其表达模式可以精准评估不孕不育的具体成因,从而制定个性化的治疗方案。
例如,在某些卵巢功能低下(diminished ovarian reserve, DOR)的患者中,研究发现NPM2(核仁蛋白2)和HSP90(热休克蛋白90)的表达水平较低,提示这些患者可能需要额外的卵巢刺激或营养支持,如补充辅酶Q10、抗氧化剂等,以提高卵母细胞质量。
3. 改进胚胎培养基,优化体外受精环境
研究发现,低质量胚胎中的代谢异常往往伴随蛋白表达的显著失调,如PRDX1、NDUFA9(线粒体呼吸链蛋白)的下调,提示这些胚胎可能对氧化应激更敏感。
未来,基于蛋白质组学数据,可以开发更优化的胚胎培养基,例如添加抗氧化剂、线粒体支持因子或蛋白质稳定剂,以提高低质量胚胎的存活率。
识别影响卵母细胞质量的关键蛋白,帮助提升卵巢功能
卵母细胞的质量直接决定了受精卵的发育潜力。随着女性年龄增长或因某些疾病(如多囊卵巢综合征、卵巢早衰等)导致卵母细胞质量下降,IVF成功率也会显著降低。该研究基于蛋白质组学,筛选出了影响卵母细胞质量的关键蛋白,为提升卵巢功能提供了新的干预靶点。
1. 线粒体功能相关蛋白:ATP合成效率决定卵母细胞质量
研究发现,线粒体ATP合成酶(ATP5A1、NDUFA9)的表达水平与卵母细胞质量呈正相关,提示能量代谢活跃的卵母细胞更具受精潜力。
在某些卵巢功能下降的女性中,这些线粒体蛋白的表达显著降低,提示线粒体能量供应不足可能是导致卵母细胞质量下降的主要因素。
未来,线粒体功能增强剂(如NAD+、辅酶Q10、复合维生素B)或许可以作为潜在的卵巢功能改善手段,提高卵母细胞的活力。
2. 母源mRNA调控蛋白:确保早期胚胎发育稳定性
该研究揭示,DDX6(RNA解旋酶)和YBX1(mRNA结合蛋白)是影响卵母细胞成熟的重要调控因子,它们负责稳定母源mRNA并确保ZGA的顺利启动。
在卵巢早衰或卵母细胞质量较差的个体中,这些蛋白的表达通常出现异常,可能影响早期胚胎发育。
综上,蛋白质组学不仅能帮助识别卵母细胞质量下降的分子机制,还可以为改善卵巢功能提供科学依据,未来可能成为个性化生殖医学的重要工具。
结合人工智能,开发自动化胚胎质量评估系统
随着人工智能(AI)和大数据技术的进步,未来生殖医学领域将逐步迈向智能化和自动化。该研究的蛋白质组学数据为AI胚胎评估系统提供了关键的生物标志物,未来可以结合机器学习算法,实现更精准的胚胎质量预测。
1. AI+蛋白质组学:自动化胚胎评分系统
传统的胚胎质量评分主要依赖形态学观察,而蛋白质组学可以提供更深入的分子层面信息。未来可以结合人工智能和质谱数据,构建智能胚胎筛选系统,综合蛋白表达、代谢状态和形态学特征,实现自动化、高精准的胚胎质量评估。
2. 早期不孕不育诊断的AI模型
通过训练AI模型分析卵母细胞和胚胎的蛋白质组数据,可以提前预测哪些患者更可能面临胚胎发育问题,从而提供更个性化的生殖治疗方案。
该研究通过单胚胎蛋白质组学,不仅揭示了胚胎筛选的新策略,还提供了提升卵母细胞质量、优化卵巢功能和提高IVF成功率的分子依据。未来,结合人工智能和精准医学,蛋白质组学有望推动生殖医学的重大突破,让不孕不育的治疗更加高效、个性化,并最终帮助更多家庭实现生育梦想。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


