NCB:实体肿瘤诱发两类系统性B细胞异常:揭示免疫治疗新挑战
来源:生物探索 2024-09-19 13:39
该研究提示了肿瘤引发的系统性免疫异常存在显著异质性,凸显未来需要针对不同类型的B细胞和髓系细胞异常制定个性化诊疗方案。
局部实体肿瘤能够与机体其他器官“对话”,引发系统性/全身性免疫变化。骨髓造血生态系统在此过程中发挥重要作用,肿瘤诱导骨髓髓系偏向造血、导致促瘤性髓系细胞积累就是典型案例。然而,尽管B细胞同样发育自骨髓,其在实体肿瘤背景下的发育变化、及其对肿瘤免疫反应的影响尚未被解答。
2023年,美国贝勒医学院张翔教授团队(共同一作为郝晓鑫,现为中国医学科学院苏州系统医学研究所研究员和沈一超)在Cell Stem Cell杂志发表了题为Osteoprogenitor-GMP crosstalk underpins solid tumor-induced systemic immunosuppression and persists after tumor removal 的论文【1】,揭示肿瘤远程重塑骨髓微环境驱动系统性髓系增生。
2024年9月12日,该团队在 Nature Cell Biology杂志在线发表了题为Solid tumour-induced systemic immunosuppression involves dichotomous myeloid–B cell interactions 的最新研究。近一步揭示肿瘤可诱导两种不同模式的系统性B细胞异常(定义为TiBA-1和TiBA-2),都与骨髓中的异常髓系生成相关。

作者在原位乳腺癌(或肺癌/黑色素瘤)模型中对骨髓细胞组份进行了全面筛查,有趣的是,发现部分肿瘤导致骨髓中pre-progenitor-B细胞下游的所有B细胞亚群数量锐减,表明B细胞的生成被肿瘤从源头阻断。作者将这类B细胞异常称为tumor-induced B cell abnormality type 1 (TiBA-1)。与之相反,部分肿瘤负荷导致骨髓中早期B细胞(主要是pro-B和pre-B)数量剧增。作者将这种表型称为TiBA-2。而不会引发B细胞发育异常的肿瘤则被归类为TiBA-0。
重要的是,骨髓中B细胞的发育异常导致肿瘤宿主外周B细胞景观显著改变。TiBA-1模型中的外周血和肿瘤中B细胞数量减少。相反, TiBA-2肿瘤小鼠的外周血和脾脏中发现了一群系统性累积的早期B细胞(CD45⁺ B220⁺ IgM⁻ CD93⁺ CD23⁻ CD21⁻ CD11b⁻),其在正常小鼠中或其他模型中并不存在。作者进而将这群细胞命名为“TiBA-2-associated early-B”(Tie-B)。重要的是,作者发现Tie-B细胞可削弱抗肿瘤免疫,并降低免疫检查点阻断(ICB)疗效,主要是通过非抗原特异性机制影响T细胞功能。
有趣的是,TiBA-1和TiBA-2模型,而非TiBA-0模型,都表现出剧烈的髓系偏向造血。对于TiBA-1,初步推测GMPs(髓系祖细胞)在骨髓微环境的“占位”可能阻碍了pre-pro-B细胞的向下分化。而在TiBA-2肿瘤宿主的骨髓中,中性粒细胞与pre-B细胞的异常互作推动了TiBA-2的形成。
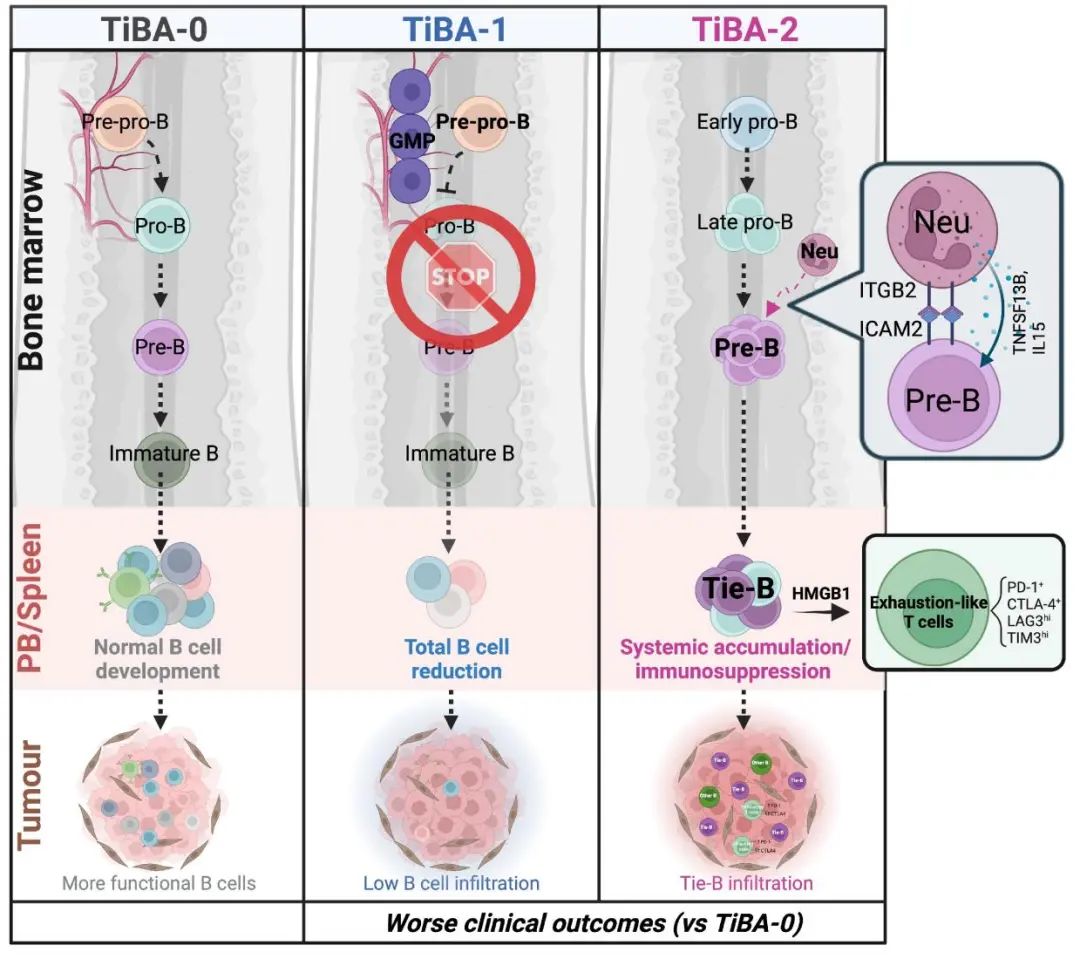
模式图(Credit: Nature Cell Biology)
TNBC患者同样表现出不同的TiBA模式,并且,TiBA与三阴性乳腺癌(TNBC)病人接受新辅助免疫治疗的预后密切相关。跟踪接受化疗联合免疫检查点阻断疗法的治疗反应发现,TiBA-1和TiBA-2患者达到完全病理反应的比例显著低于TiBA-0患者。该研究提示了肿瘤引发的系统性免疫异常存在显著异质性,凸显未来需要针对不同类型的B细胞和髓系细胞异常制定个性化诊疗方案。
郝晓鑫(现为中国医学科学院苏州系统医学研究所研究员)和沈一超分别为论文的第一作者和共同第一作者,张翔教授(美国贝勒医学院)为论文通讯作者。联合去年发表的论文【1】,这两项研究体现了造血系统在介导肿瘤系统性免疫异常中的重要作用。
参考文献:
1 Hao, X. et al. Osteoprogenitor-GMP crosstalk underpins solid tumor-induced systemic immunosuppression and persists after tumor removal. Cell Stem Cell 30, 648-664 e648 (2023). https://doi.org:10.1016/j.stem.2023.04.005
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


