J Nanobiotechnology:基于Cu掺杂多多巴胺的纳米系统(DSF@CuPDA-PEGM)用于肿瘤精准治疗
来源:生物谷原创 2024-10-30 10:59
本研究通过氧化聚合和cu螯合合成了负载cu的聚多巴胺(CuPDA),随后用peg -甘露糖修饰(CuPDA- pegm)增强了对glut1过表达癌细胞的靶向能力。
结直肠癌(CRC)是第三大常见肿瘤,发病率和死亡率都很高。化疗是治疗结直肠癌的主要策略,特别是对于无法切除病变的患者。然而,目前的化疗药物(如氟尿嘧啶和奥沙利铂)由于非特异性毒性和靶向能力差,对健康组织造成不利且不可避免的损伤,并严重存在肿瘤耐药,导致治疗效果有限,副作用严重。因此,迫切需要开发肿瘤特异性治疗药物或策略,以精确根除结直肠肿瘤,使其能够在正常组织中隐藏其毒性,并释放肿瘤中的抗肿瘤作用,以消除药物敏感和耐药的癌细胞。
双硫仑(DSF)是一种用于治疗酒精中毒的临床药物,最近被证明具有抗癌特性。DSF本身具有低毒性,但与铜离子的相互作用导致形成有毒的Cu(DDC)2。形成的复合物与NPL4结合,使p97-NPL4-UFD1通路失能,从而诱导细胞凋亡。因此,DSF的细胞杀伤作用高度依赖于铜离子,使DSF具有选择性毒性。为了增强以DSF为基础的化疗,人们开发了多种DSF/Cu2+共递送纳米系统,这些纳米系统促进细胞内化后酸性条件引发的Cu2+在肿瘤中的积累和释放,以生成Cu(DDC)2。
然而,这些纳米系统也可以在非癌细胞的酸性内切酶/溶酶体中释放Cu离子,从而允许Cu2+/DSF螯合,从而对正常组织产生潜在的毒性。此外,由于cu催化的fenton样反应,Cu2+泄漏会促进活性氧(ROS)的产生,诱导细胞氧化应激和非特异性毒性。因此,理想的基于dsf的治疗系统需要在肿瘤组织或细胞内特异性释放Cu2+,从而允许原位合成Cu(DDC)2以精确根除肿瘤。
活性氧(ROS)包括多种氧代谢产物的活性化学物质,在调节细胞功能中起着至关重要的作用。癌细胞生活在一种异常的氧化还原稳态中。癌细胞的过度增殖和活跃代谢导致ROS过量产生,癌细胞增加抗氧化系统以维持氧化还原平衡。与正常细胞和组织相比,肿瘤细胞和微环境中过氧化氢(H2O2)水平显著升高(~ 100µM)。
值得注意的是,耐药癌细胞中的H2O2含量甚至高于药物敏感的亲本癌细胞。肿瘤和正常组织中H2O2水平的明显差异可能是设计精确消除肿瘤的治疗性纳米系统的一个有希望的关键。值得注意的是,Cu(DDC)2复合物已被证明可以促进细胞ROS的产生,从而提高H2O2水平。

图片来源:https://doi.org/10.1186/s12951-024-02825-6
近日,来自华中科技大学同济医学院的研究者们在J Nanobiotechnology杂志上发表了题为“Tumor specific in situ synthesis of therapeutic agent for precision cancer therapy”的文章,该研究表明基于Cu掺杂多多巴胺的纳米系统(DSF@CuPDA-PEGM)用于肿瘤精准治疗,提供了肿瘤治疗的一种新途径。
传统的化疗药物存在选择性差、靶向性差、耐药等问题,开发肿瘤特异性疗法对于精确消除肿瘤,同时避免对正常组织的毒性至关重要。双硫仑(DSF)是fda批准的一种治疗酒精依赖的药物,通过与铜离子(Cu(DDC)2)形成配合物而具有抗肿瘤作用。在这里,研究者开发了一种基于Cu掺杂多多巴胺的纳米系统(DSF@CuPDA-PEGM)来实现原位生成有毒Cu(DDC)2。
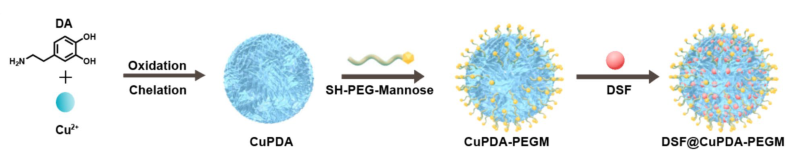
DSF@CuPDA-PEGM的制备过程
图片来源:https://doi.org/10.1186/s12951-024-02825-6
研究结果表明:在H2O2含量升高的癌细胞中,CuPDA响应性降解释放Cu离子和DSF,允许现场合成具有强抗肿瘤活性的Cu(DDC)2。DSF@CuPDA-PEGM对药物敏感和耐药的癌细胞都有很好的治疗效果,同时对非癌细胞的毒性降到最低。此外,DSF@CuPDA-PEGM通过诱导癌细胞免疫原性死亡来促进免疫反应,从而增强了基于pd -1的免疫检查点阻断治疗。
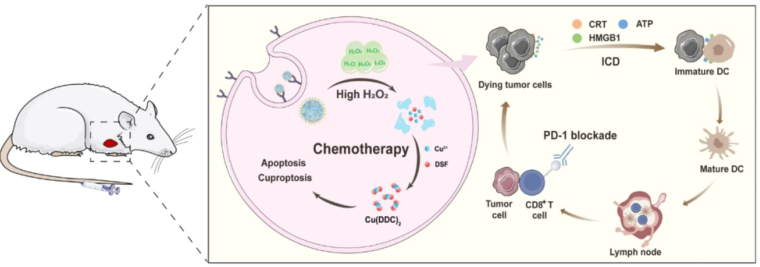
DSF@CuPDA-PEGM精确治疗肿瘤的机制图
图片来源:https://doi.org/10.1186/s12951-024-02825-6
综上所述,本研究通过氧化聚合和cu螯合合成了负载cu的聚多巴胺(CuPDA),随后用peg -甘露糖修饰(CuPDA- pegm)增强了对glut1过表达癌细胞的靶向能力。在高浓度H2O2存在下,CuPDA被响应性降解并释放出螯合在纳米颗粒中的Cu离子。因此,负载DSF的CuPDA-PEGM可以在高H2O2含量的癌细胞中特异性释放Cu2+和DSF,从而原位合成Cu(DDC)2复合物,激活DSF的抗肿瘤作用,从而有效杀伤药敏和耐药癌细胞。本研究不仅为精确肿瘤治疗提供了特异性和有效的治疗纳米系统,而且为促进ICB免疫治疗提供了强有力的策略。 (生物谷 Bioon.com)
参考文献:
Zhixin Zhou et al. Tumor specific in situ synthesis of therapeutic agent for precision cancer therapy. J Nanobiotechnology. 2024 Oct 10;22(1):612. doi: 10.1186/s12951-024-02825-6.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


