为什么饮食健康还会胆固醇高?Nature揭示“有害”胆固醇在体内发挥作用的分子机制
来源:生物谷原创 2024-12-23 12:09
这项研究揭示了apoB100与LDLR相互作用背后的分子机制,为开发针对胆固醇代谢异常的新疗法开辟了道路。
为什么有些人即使饮食健康、生活规律,仍然无法摆脱高胆固醇的困扰?这一切可能要归咎于一种名为载脂蛋白B100(apoB100,Apolipoprotein B100)的小分子。它不仅是低密度脂蛋白(LDL)的关键结构成分,还是LDL受体(LDLR)的“舞伴”。当它们之间的“舞蹈”出现问题时,就会导致家族性高胆固醇血症(FH),这是一种常见的遗传病,其特征是血液中LDL胆固醇(LDL-C)显著升高,并增加了心血管疾病的风险。
近日,一篇发表在国际杂志Nature上题为“Structure of apolipoprotein B100 bound to the low-density lipoprotein receptor”的研究报告中,来自美国国立卫生研究院等机构的科学家们取得了重大突破,首次揭示了apoB100如何与LDLR结合,开启了从血液中清除有害胆固醇的过程。这项研究不仅帮助科学家们更好地理解了LDL促进心脏病发生的分子机制,还为开发更有效的降胆固醇疗法提供了新的视角。正如医学博士Alan Remaley所说,“如果你想打败敌人,就必须了解它的长相。” 研究人员终于能够一窥这个“敌人”的真面目。

打个比方,LDL就像是一艘装满胆固醇的船,而apoB100则是这艘船上的关键舵手。当这艘船靠近细胞时,LDLR会伸出“手臂”抓住apoB100,从而将胆固醇卸载到细胞内。然而,如果舵手或“手臂”出了问题——例如由于基因突变——那么这艘船就无法顺利停靠,胆固醇就会在血液中堆积,最终沉积在动脉壁上,形成斑块,进而引发动脉粥样硬化和心脏病。
为了观察这一过程,研究人员使用了一种叫做冷冻电子显微镜(cryo-EM)的技术,这种技术就像是给分子拍了一张高清照片,使得科学家们可以清晰地看到apoB100与LDLR结合时的完整结构。研究者Joseph Marcotrigiano博士解释说,“LDL体积巨大且形状不规则,这让研究变得非常复杂。现在我们能观察到如此多的细节,开始理解它是如何工作的。”
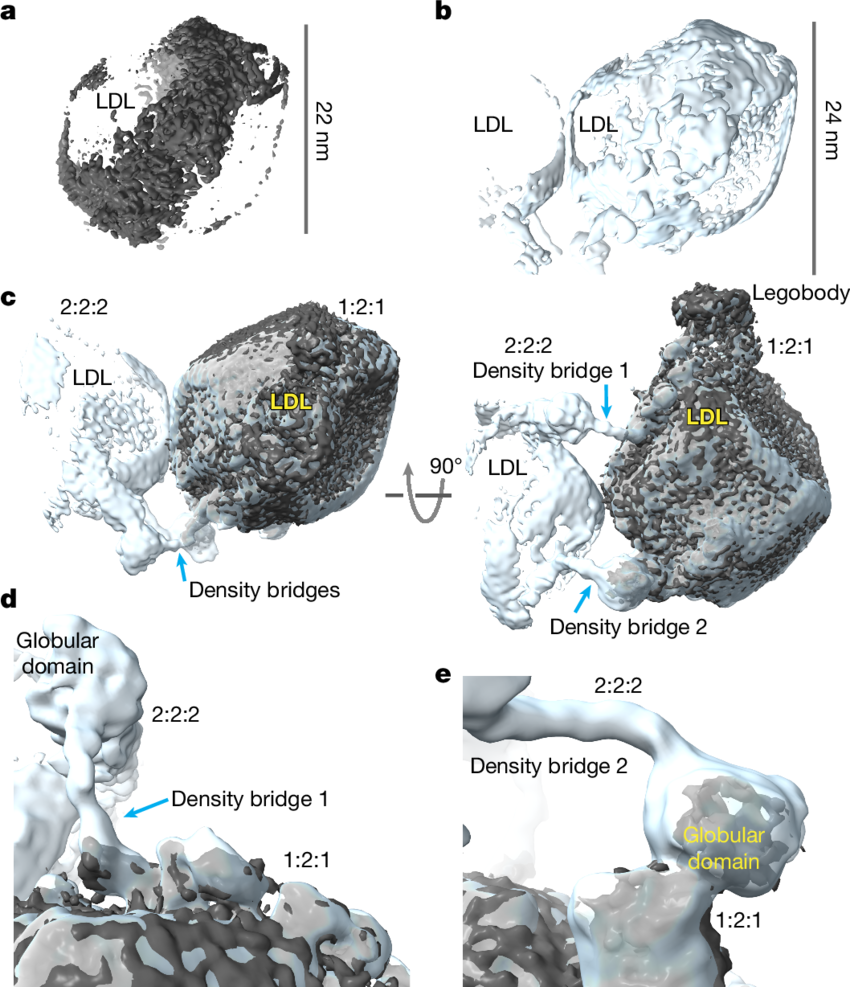
LDL-LDLR-legobody的1:2:1和2:2:2复合体的Cryo-EM重建
此外,研究人员还利用人工智能驱动的蛋白质预测软件模拟了apoB100与LDLR的结合方式。这一工具最近获得了2024年的诺贝尔化学奖,虽然其开发者并未直接参与这项研究,但该软件的帮助使得科学家们能够找到那些引起机体LDL水平升高的基因突变。他们发现,许多与LDL和LDLR连接位置有关的突变都与家族性高胆固醇血症(FH)的发生密切相关。这些突变使得患者体内的LDL吸收出现缺陷,导致LDL水平升高,并增加了早期患心脏病的风险。
通过精确了解LDLR如何以及在哪里与LDL结合,研究人员希望设计出能够靶向这些连接点的新药物,以降低血液中的LDL水平。这种方法不仅可以帮助那些携带FH相关突变的人群,也能为那些不携带突变但胆固醇水平较高的人提供更好的治疗选择,比如通过增加细胞中LDLR的数量来减少LDL。
综上所述,这项研究揭示了apoB100与LDLR相互作用背后的分子机制,为开发针对胆固醇代谢异常的新疗法开辟了道路。未来,科学家们或许能找到更多方法来阻止这两位“致命舞伴”的不当行为,保护更多人免受心血管疾病的威胁。(生物谷Bioon.com)
参考文献:
Reimund, M., Dearborn, A.D., Graziano, G. et al. Structure of apolipoprotein B100 bound to the low-density lipoprotein receptor. Nature (2024). doi:10.1038/s41586-024-08223-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


