两篇 Cell 发现了对抗耐药细菌感染的新方法
来源:生物谷原创 2025-10-01 10:54
通过理解和利用这种分子海盗行为,研究人员相信他们可以重新设计卫星,以靶向抗生素耐药性细菌,克服生物膜等顽固的细菌防御机制,甚至开发强大的新型诊断工具。
在一项新的研究中,帝国理工学院的科学家们揭示了噬菌体如何通过一种可潜在用于医学的"微生物海盗行为",劫持其他病毒以突破细菌细胞并进行传播。
这项发表在《细胞》杂志上的发现,揭示了细菌获取新遗传物质(包括使其更具毒性或更耐抗生素的性状)的一条主要途径。研究人员认为,它也可能为应对全球抗菌素耐药性威胁和开发快速诊断工具开辟新途径。

噬菌体是感染并杀死细菌的病毒。它们是地球上最丰富的生物体之一,并且通常具有高度特异性,每种噬菌体都专门攻击一种细菌物种。在结构上,它们类似于微型注射器:一个包裹着DNA的"头部"和一个尾部,尾部末端带有尖刺状纤维,可以锁定细菌并注入其遗传物质。但噬菌体本身也并非免于寄生。它们会被称为"噬菌体卫星"的小型遗传元件靶向,这些卫星会劫持噬菌体自身的遗传机制进行繁殖。
在这项最新研究中,帝国理工学院的研究人员重点研究了一个强大的噬菌体卫星家族,称为"衣壳形成型噬菌体诱导染色体岛(capsid-forming phage-inducible chromosomal islands, cf-PICI)"。这些遗传元件可以传播抗生素耐药性和毒力基因,并在超过200种细菌物种中发现。然而,它们究竟如何能够如此高效地传播,此前尚不清楚。
微生物海盗行为
研究团队于2023年首次发现,cf-PICIs可以构建自己的衣壳(病毒"头部"),但它们缺乏尾部,这意味着它们自身只能产生非感染性颗粒——即无法感染噬菌体。在这项最新工作中,帝国理工学院细菌耐药性生物学中心的研究人员发现了谜题缺失的部分:cf-PICIs会劫持来自不相关噬菌体的尾部,从而创造出混合的"嵌合"病毒。其结果是产生一种嵌合噬菌体,其自身衣壳内携带cf-PICI的DNA,但附着了一个源自噬菌体的尾部。
关键在于,一些cf-PICIs可以劫持来自完全不同噬菌体物种的尾部,从而有效扩大其宿主范围。因为尾部决定了靶向哪些细菌,这种海盗行为使cf-PICIs能够渗透到新的细菌物种中,这解释了它们在自然界中的广泛存在。
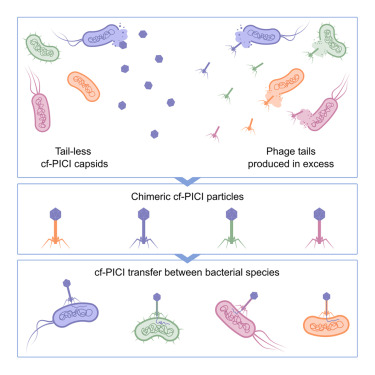
据研究人员称,这一发现可能对科学界具有重要意义。通过理解和利用这种分子海盗行为,研究人员相信他们可以重新设计卫星,以靶向抗生素耐药性细菌,克服生物膜等顽固的细菌防御机制,甚至开发强大的新型诊断工具。
"这些'海盗卫星'不仅告诉我们细菌如何共享危险性状,"帝国理工学院生命科学系的Tiago Dias da Costa博士解释说。"它们还可能启发下一代疗法和检测方法,以智取我们面临的一些最棘手的感染。"
帝国理工学院传染病系的Jose Penades教授说:"我们早期的工作首次识别了这些奇特的遗传元件,发现它们实际上是一种'寄生虫的寄生虫'。我们现在知道,这些可移动遗传元件形成的衣壳可以交换从其他噬菌体获取的'尾部',从而将自己的DNA送入宿主细胞。这是进化生物学中一个巧妙的特性,但它也让我们更多地了解了抗生素耐药性基因如何通过称为'转导'的过程进行传播。"
Dias da Costa博士补充说:"这项实验工作进一步阐明了细菌中一种关键的基因转移方法。如果我们能够利用和改造cf-PICIs,它可能为我们对抗抗菌素耐药性提供一个有价值的新工具。"
人工智能(AI)合作科学家工具
在一个通过弗莱明倡议(伦敦帝国理工学院与帝国理工学院医疗保健NHS信托基金会的合作伙伴关系)协调的相关项目中,研究人员利用他们的实验工作来验证由谷歌开发的一个突破性AI平台。
该平台被称为"合作科学家(co-scientist)",旨在帮助科学家设计更智能的实验并加速发现。这项研究也发表在《细胞》杂志上。

为了测试该平台,帝国理工学院的团队提出了驱动他们自身工作的相同基本科学问题:cf-PICIs是如何在如此多的细菌物种中传播的?
以此起点为基础,并利用网络搜索、研究论文和数据库,AI独立生成的假设与团队自身经过实验验证的想法相吻合——有效地指出了那些花费了数年工作才确立的相同实验,但AI在几天内就完成了。
研究人员表示,这显示了AI系统"超级助力科学"的巨大潜力,不是通过取代人类的洞察力,而是通过加速它来实现。他们目前正与谷歌合作,进一步开发该平台,并探索它如何改变生物医学研究的步伐。(生物谷Bioon.com)
参考文献:
Lingchen He et al, Chimeric infective particles expand species boundaries in phage-inducible chromosomal island mobilization, Cell (2025). DOI: 10.1016/j.cell.2025.08.019.
José R. Penadés et al, AI mirrors experimental science to uncover a mechanism of gene transfer crucial to bacterial evolution, Cell (2025). DOI: 10.1016/j.cell.2025.08.018.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


