Nat Chem Biol | 北京大学王初/肖俊宇通过热蛋白质组分析发现金属结合蛋白
来源:生物探索 2024-03-05 16:41
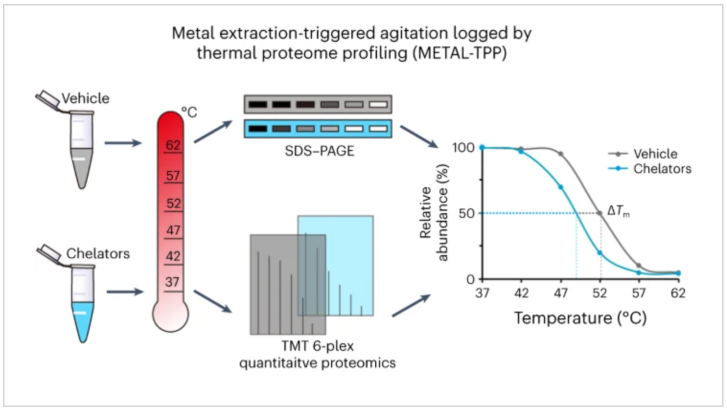
基于金属对维持MBPs结构稳定性这一基本原理,作者在此开发了一种化学蛋白质组学方法,名为METAL-TPP,以全局范围内分析和发现蛋白质组中的MBPs。
北京大学王初及肖俊宇共同通讯(曾欣、魏田田、王相贺及刘源为本文的共同第一作者)在Nature Chemical Biology 在线发表题为“Discovery of metal-binding proteins by thermal proteome profiling”的研究论文,该研究报告了一种名为“热蛋白质组分析记录的金属提取触发搅拌”(METAL-TPP)的化学蛋白质组学方法,对蛋白质组中的MBPs进行全局分析。

金属结合蛋白(Metal-binding proteins, MBPs)普遍存在于所有生物系统中,估计约占整个蛋白质组的三分之一。它们在催化、结构稳定和信号转导等多种生物过程中发挥着不可或缺的作用。也有报道称,许多人类疾病,如神经退行性疾病和癌症,与功能失调的MBPs密切相关。
金属蛋白质组学是一个特定的分支学科,旨在全面表征蛋白质组在细胞或组织水平上的MBPs,迄今为止已经开发了几种代表性的方法。Cvetkovic和同事将色谱分离、电感耦合等离子质谱(ICP-MS)和高通量串联质谱(HT-MS/MS)相结合,发现了四种新的金属蛋白。Smith等人采用固定化金属亲和层析(IMAC)和液相层析-串联质谱(LC-MS /MS)鉴定具有铜结合能力的肝细胞蛋白。
Sevcenco等人利用MIRAGE方法在大肠杆菌中研究了可溶性铁和锌金属蛋白质组,该方法利用培养细胞中特定过渡金属离子的放射性同位素。最近,还报道了两种化学蛋白质组学方法。Weerapana及其同事开发了一个基于竞争性活性的蛋白质分析(ABPP)平台,用于鉴定人类蛋白质组中的锌结合蛋白和大肠杆菌中的铁硫(Fe-S)蛋白。Hamachi及其同事使用锌反应标记试剂和LC-MS /MS鉴定锌稳态中的蛋白质。此外,生物信息学通过已知的一致序列和/或结构基序预测MBPs和金属结合位点为金属蛋白质组的研究提供了一种新的途径。
模式图(Credit: Nature Chemical Biology)
热移测定(TSA)在配体与单个蛋白质结合的研究中得到了广泛的探索,其基本原理是配体结合会导致靶蛋白的热稳定性增加。Savitski等人将细胞TSA (CETSA)14和基于串联质量标签(TMT)的多重定量蛋白质组学相结合,开发了一种称为热蛋白质组分析(TPP)的方法,可以在蛋白质组水平上对活细胞中的药物靶标进行无偏鉴定。随后,TPP也被用于发现蛋白质组中其他类型的生物分子相互作用:蛋白质-蛋白质相互作用(PPIs)、代谢物-蛋白质结合、功能性蛋白质修饰等。有趣的是,许多研究报告称,金属也会热稳定MBPs。例如,精氨酸酶是一种双核Mn2+金属酶,可将L-精氨酸转化为L-鸟氨酸和尿素。当Mn2+从酶中耗尽时,其热稳定性和酶活性大大降低。
基于金属对维持MBPs结构稳定性这一基本原理,作者在此开发了一种化学蛋白质组学方法,名为METAL-TPP,以全局范围内分析和发现蛋白质组中的MBPs。该方法包括使用螯合剂从MBPs中提取金属,并通过热蛋白质组分析监测由此产生的蛋白质稳定性变化。将METAL-TPP与广谱螯合剂EDTA应用于人类蛋白质组,发现了一组热稳定性降低的蛋白质,这些蛋白质包含先前已知的MBPs和目前未注释的MBP候选蛋白。其中一个潜在靶点谷氨酰胺-果糖-6-磷酸转氨酶2 (GFPT2)的生化表征表明,锌结合该蛋白,抑制其酶活性并调节己糖胺的生物合成途径。使用另一种螯合剂TPEN进行METAL-TPP分析,发现了蛋白质组中额外的MBPs。该研究为MBPs的蛋白质组学发现提供了强有力的工具,并为金属在细胞生物学中的功能研究提供了丰富的资源。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


