Cell子刊:陈水冰/杨柳柳等构建血管化巨噬细胞-胰岛类器官,揭示病毒感染引起的胰岛β细胞焦亡
来源:生物世界 2024-09-06 10:03
威尔康奈尔医学院
威尔康奈尔医学院陈水冰教授、杨柳柳(现为中国医学科学院血液病医院/血液学研究所研究员)等人在 Cell Stem Cell 期刊发表了题为:Human vascularized macrophage-islet organoids to model immune-mediated pancreatic β cell pyroptosis upon viral infection 的研究论文。
该研究开发了人多能干细胞(hPSC)来源的血管化巨噬细胞-胰岛(VMI)类器官,用于模拟病毒感染引起的免疫介导的胰岛β细胞焦亡,揭示了促炎性巨噬细胞通过分泌IL-1β并通过TNFSF12-TNFRSF12A通路与β细胞相互作用,从而导致β细胞焦亡。
该研究利用hPSC来源的VMI类器官建立了一种研究免疫细胞介导的宿主损伤的有价值工具,并揭示了病毒暴露期间β细胞损伤的机制。

在传染病领域,多种机制共同导致观察到的宿主损伤。之前的研究发现,SARS-CoV-2感染可诱导人类β细胞的转分化和β细胞损伤。此外,据报道COVID-19患者的肺部和心脏会出现巨噬细胞的积聚。稳健的人类模型将有助于进一步了解免疫细胞介导的宿主损伤。
人类多能干细胞(hPSC)提供了一个强大的体外平台,用于研究疾病机制、开发细胞疗法方法和药物筛选。陈水冰团队此前开发了一种二维(2D)共培养系统,利用hPSC来源的心肌细胞和巨噬细胞,并鉴定出一种JAK抑制剂,能够有效阻止巨噬细胞对心肌细胞的损伤。
在这项最新研究中,研究团队运用空间多组学分析技术全面分析了COVID-19患者的胰腺病理样本,发现COVID-19样本中存在促炎性巨噬细胞的积累,单细胞RNA测序(scRNA-seq)分析证实,暴露于新冠病毒(SARS-CoV-2)或柯萨奇病毒B4型(CVB4)的人类胰岛β细胞中存在促炎巨噬细胞的激活,并显示出细胞焦亡通路的富集。
接下来,研究团队开发了一种含有人多能干细胞(hPSC)来源的内分泌细胞、巨噬细胞和内皮细胞的血管化巨噬细胞-胰岛(VMI)类器官模型,发现促炎性巨噬细胞通过分泌IL-1β并通过TNFSF12-TNFRSF12A通路与β细胞相互作用,从而导致β细胞发生细胞焦亡。
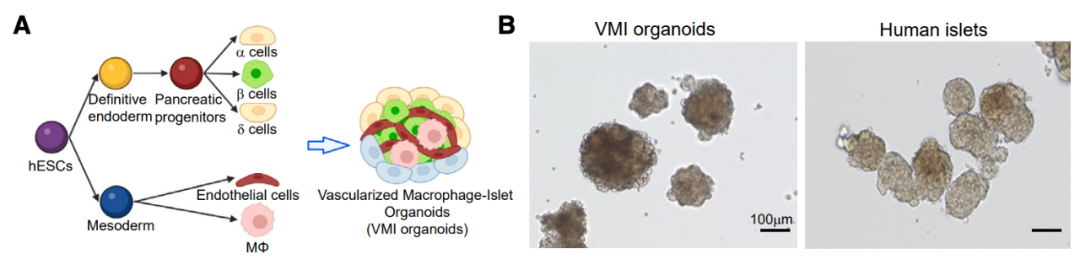
总的来说,这项研究不仅建立了一种hPSC来源的血管化巨噬细胞-胰岛(VMI)类器官模型来研究巨噬细胞介导的宿主损伤,还发现了在传染病中以前未知的TNFSF12-TNFRSF12A介导的β细胞损伤的机制——细胞焦亡。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


