Nature子刊:张军杰团队揭示STING全新功能,作为代谢检查点促进抗肿瘤免疫
来源:生物世界 2023-07-17 11:08
STING是对病毒和细菌免疫反应的关键调节因子,并有助于抗肿瘤免疫。在几种癌细胞系中都观察到了STING信号的抑制,并且STING蛋白的表达随着某些癌症类型的进展而降低,例如黑色素瘤。
STING是对病毒和细菌免疫反应的关键调节因子,并有助于抗肿瘤免疫。在几种癌细胞系中都观察到了STING信号的抑制,并且STING蛋白的表达随着某些癌症类型的进展而降低,例如黑色素瘤。这些发现表明,STING是一种细胞内在肿瘤抑制因子。激活STING通路用于癌症治疗的想法已经在许多临床前研究中得到了证实,并开始进入临床试验中。但STING具体如何发挥抗癌作用,以及是否依赖于其天然免疫活性等尚不清楚。
武汉大学医学研究院、免疫与代谢前沿科学中心、病毒学国家重点实验室张军杰教授课题组在 Nature Cell Biology 期刊发表了题为:STING is a cell-intrinsic metabolic checkpoint restricting aerobic glycolysis by targeting HK2 的研究论文。
这项研究表明,STING具有独立于其天然免疫功能的新功能——作为细胞内在代谢检查点,通过靶向己糖激酶2(HK2)来限制有氧糖酵解。
具体来说,STING以己糖激酶2(HK2)为靶点,阻断其己糖激酶活性,从而限制肿瘤的有氧糖酵解,促进体内抗肿瘤免疫。这一发现对开发基于STING的疗法来改善抗肿瘤免疫治疗具有重要意义。

在这项研究中,研究团队发现,STING的敲除明显促进糖酵解,导致乳酸产生增加。此外,DNA病毒感染或细胞质DNA刺激引发STING降解,同样可以促进糖酵解。代谢组学分析及同位素标记葡萄糖碳流追踪实验也表明STING敲除显著提高糖酵解产物的水平。通过使用各种抑制剂抑制STING降解或回补表达STING均能抑制糖酵解。有趣的是,即使表达丧失天然免疫活性的STING突变体,依然能够抑制糖酵解,这表明STING调控糖代谢不依赖于其天然免疫活性。
机制研究显示,STING与糖酵解的限速酶己糖激酶2(HK2)结合,并限制HK2的线粒体定位,从而抑制其活性,进而抑制糖酵解过程。研究团队进一步鉴定出STING的第二位脯氨酸对于与HK2结合及限制糖酵解至关重要。小鼠实验也验证了这一发现,在小鼠结肠癌肿瘤模型中,STING通过靶向HK2抑制糖酵解促进肿瘤免疫反应,抑制肿瘤生长。
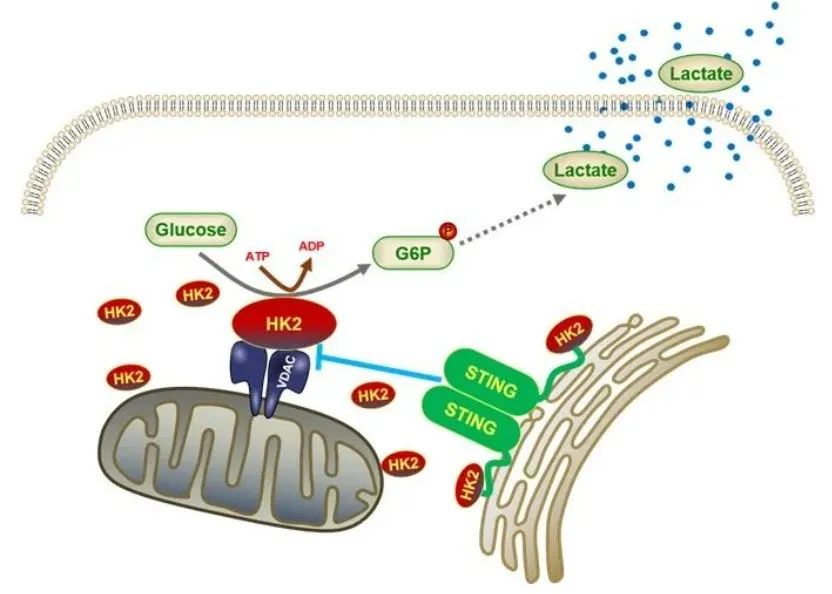
STING靶向HK2抑制糖酵解促进肿瘤免疫反应
此外,研究团队还在人类结直肠癌患者样本中发现,乳酸可以作为有氧糖酵解的替代物,STING的表达水平与肿瘤免疫呈正向关,与乳酸水平呈负相关。
该研究不仅揭示了STING不依赖于天然免疫活性的调控糖酵解的新功能,也能够解释为何在多种癌细胞中STING呈沉默或低表达状态,这一发现也为提高靶向STING的肿瘤免疫治疗手段提供了指导。
武汉大学医学研究院2019级博士研究生张丽婷为该论文的第一作者,武汉大学中南医院江从庆教授为并列第一作者。武汉大学医学研究院、免疫与代谢前沿科学中心、病毒学国家重点实验室张军杰教授为论文通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


