Nature子刊:我国学者开发新型蛋白靶向降解技术——FRTAC,高效降解膜蛋白
来源:生物世界 2025-06-19 11:44
该研究表明,FRTAC 可以靶向肿瘤部位,与 FRα 交联获得高亲和力,并以亚纳摩尔级活性降解膜蛋白,包括 EGFR、TROP2、PD-L1 和 HER2,具有良好的癌症治疗应用前景。
蛋白靶向降解嵌合体(PROTAC),依靠将泛素连接酶招募到细胞内的目标蛋白上,通过蛋白酶体机制促进对致病蛋白的降解,使许多“不可成药”蛋白成为治疗靶点。迄今已有数十种 PROTAC 药物进入临床试验阶段,其中,靶向雌激素受体(ER)的 PROTAC 药物 Vepdegestrant 近日发布了 3 期临床试验结果,有望于近期上市。
与 PROTAC 类似,科学家们还开发出了溶酶体靶向降解嵌合体(LYTAC)、自噬体靶向降解嵌合体(AUTAC)等技术。PROTAC 和 AUTAC 主要靶向胞内蛋白,而 LYTAC 通常专注于捕获分泌蛋白和膜蛋白并进行降解,例如生长因子、疾病相关受体和细胞因子等,这些蛋白质约占人类蛋白质组的 40%,是许多疾病的重要治疗靶点。
然而,由于溶酶体转运受体的多样性有限,LYTAC 的发展面临着巨大挑战。
2025 年 6 月 13 日,军事医学研究院周辛波、钟武、中国医学科学院北京协和医学院邓洪斌等人在 Nature 子刊 Nature Chemical Biology 上发表了题为:Polyvalent folate receptor-targeting chimeras for degradation of membrane proteins 的研究论文。
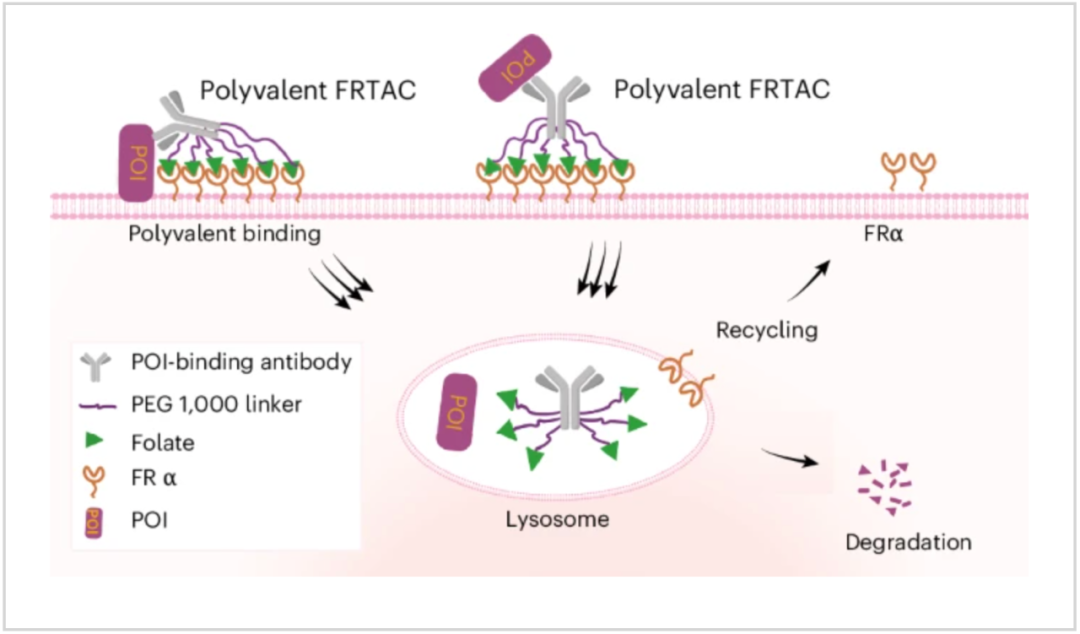
该研究发现叶酸受体α(FRα)是一种新的溶酶体转运受体类别,能够促进膜蛋白的溶酶体降解,并在此基础上开发了一种新型蛋白靶向降解平台——叶酸受体靶向降解嵌合体(FRTAC),能够高效靶向降解膜蛋白,具有良好的癌症治疗应用前景。

在这项最新研究中,研究团队发现,叶酸受体α(FRα)是一种新的溶酶体转运受体类别,能够促进膜蛋白的溶酶体降解。
在这一发现的基础上,研究团队通过将多个叶酸分子通过 PEG1000 linker 与抗体蛋白偶联到一起,建立了一个新型蛋白靶向降解平台——叶酸受体靶向降解嵌合体(FRTAC)。FRTAC 被过表达 FRα 的癌细胞选择性内化,使细胞膜上的目标蛋白被转运到溶酶体进行降解。同时,FRα 从 FRTAC 中释放并回收到细胞膜中。优化后的 FRTAC 在清除细胞膜蛋白方面表现出亚纳摩尔级效力,其功效取决于 FRα 的表达和溶酶体活性。
研究团队使用该平台构建了靶向 EGFR 的 FR-Ctx 和靶向 PD-L1 的 FR-Atz。结果显示,FR-Ctx 抑制了癌细胞增殖,而 FR-Atz 则增强了 T 细胞介导的对肿瘤细胞的细胞毒性。
此外,FR-Atz 在前列腺癌小鼠模型和人源化黑色素瘤小鼠模型中均表现出强大的体内 PD-L1 靶向降解效率,并通过将肿瘤微环境从免疫抑制状态重编程为免疫刺激状态,引发了肿瘤特异性免疫反应,表现出优于传统抗体药物的治疗效果。
总的来说,该研究表明,FRTAC 可以靶向肿瘤部位,与 FRα 交联获得高亲和力,并以亚纳摩尔级活性降解膜蛋白,包括 EGFR、TROP2、PD-L1 和 HER2,具有良好的癌症治疗应用前景。
军事医学研究院副研究员肖典、中国医学科学院博士董靖雯、军事医学研究院高级实验师谢菲、清华大学与军事医学研究院联合培养博士生冯薰为论文共同第一作者,军事医学研究院周辛波研究员、中国医学科学院邓洪斌研究员、军事医学研究院钟武研究员为共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


