《科学》:改写教科书!科学家首次发现,杀伤性T细胞耐受的关键在于被胸腺驱逐,而不是被胸腺杀死
来源:奇点糕 2023-11-10 14:21
他们还通过敲除编码S1P1的基因,证实CD8阳性T细胞耐受的建立,确实取决于未成熟的自反应CD8阳性T细胞被胸腺驱逐。
由美国国家癌症研究所Alfred Singer和Mohamed Elsherif Badr领衔的研究团队,在顶级期刊《科学》上发表了一篇研究论文[1],证实之前的认知其实是错误的。
他们发现,那些具有自反应活性的不成熟CD8阳性T细胞的肉体其实没有被消灭,而是被赶出了胸腺进入外周,经过历练之后,最终成为了成熟的、被机体耐受的T细胞。
如此一来,胸腺大义灭亲的剧本,就要改成胸腺虎毒不食子并驱逐不孝子的剧本了。
论文首页截图
那Singer/Badr团队是如何发现胸腺“驱逐爱子”这个秘密的呢?
他们在查阅建立CD8阳性T细胞耐受相关文献的时候发现,小鼠和人的胸腺中通常没有携带自反应TCR且功能成熟的CD8阳性T细胞,但在外周却会出现这些细胞。
为了维护克隆删除这一假说,有人认为,带有自反应TCRs的成熟CD8阳性T细胞出现在外周,是因为胸腺中的克隆删除不完善。但是,Singer/Badr团队认为,这种说法无法解释胸腺中不存在的自反应CD8阳性T细胞为何在外周的数量却没有减少。
基于小鼠实验,Singer/Badr团队发现,在胸腺启动克隆清除的阴性选择(清除自反应CD8阳性T细胞)后,未成熟的自反应CD8阳性T细胞居然存活下来了,没有被大规模消灭(死亡不足1%)。
还有一个现象引起了Singer/Badr团队的注意。正常情况下,未成熟的胸腺细胞是不能跑到胸腺外面的,但是他们却发现未成熟的自反应CD8阳性T细胞竟被胸腺驱逐到了外周。如此看来,胸腺也难以承受自反应CD8阳性T细胞。
但是胸腺究竟是如何驱逐这些不成熟的胸腺细胞的呢?
Singer/Badr团队发现,原来强烈的TCR信号会下调转录抑制因子Gfi1的表达,导致未成熟自反应CD8阳性T细胞的S1P1表达水平升高,正是S1P1启动了克隆驱逐,让未成熟的胸腺细胞早早脱离胸腺进入外周。
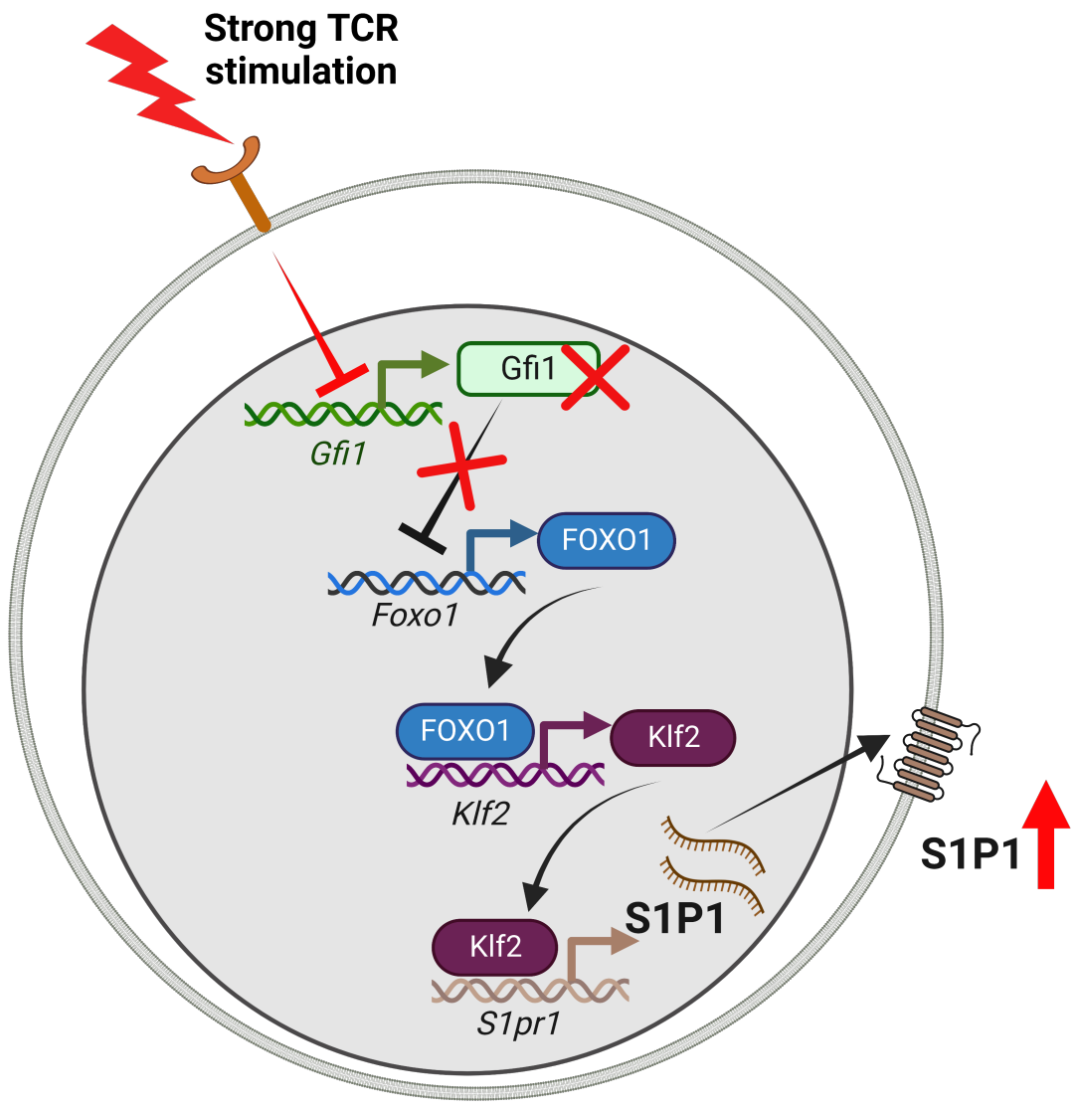
TCR调节S1P1的机制
接下来的问题是,胸腺将未成熟的自反应CD8阳性T细胞赶出家门,难道身体不会遭殃么?究竟如何才能实现免疫耐受呢?
研究结果再一次出乎Singer/Badr团队的预料。尽管小鼠外周CD8阳性T细胞携带有自反应TCR,但是它们终身保持健康,因为这些CD8阳性T细胞经过发育之后,成为具有自我耐受性的CD8阳性T细胞。
更重要的是,他们还通过敲除编码S1P1的基因,证实CD8阳性T细胞耐受的建立,确实取决于未成熟的自反应CD8阳性T细胞被胸腺驱逐。
至于未成熟的自反应CD8阳性T细胞在外周分化成自我耐受的CD8阳性T细胞的原因,Singer/Badr团队推测可能有两个:一方面,它们在第一次遇到外周自身配体时功能尚未成熟,从而降低了TCR和CD8共受体分子的表达;另一方面,它们获得了调节功能。
总的来说,Singer/Badr团队的这一发现,改写了我们对CD8阳性T细胞耐受的认知,对于相关疾病的治疗具有重要意义。
参考文献:
[1].Badr ME, Zhang Z, Tai X, Singer A. CD8 T cell tolerance results from eviction of immature autoreactive cells from the thymus. Science. 2023;382(6670):534-541. doi:10.1126/science.adh4124
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


