《科学》子刊:脾脏竟是抗癌免疫治疗的“兵工厂”!麻省理工科学家发现,脾脏内耗竭中期CD8+T细胞是响应免疫治疗、向肿瘤浸润的主力
来源:奇点糕 2024-10-10 10:34
响应免疫治疗召唤、浸润到肿瘤部位的肿瘤特异性CD8+T细胞,是从全身哪些部位来的呢?
近日,麻省理工学院(MIT)科赫综合癌症研究所的研究者们在Science Immunology期刊发表的研究成果,就揭示了脾脏在癌症免疫治疗时代的全新价值:脾脏白髓内有一批处于耗竭中期(Intermediate-exhausted)的CD8+T细胞,它们会在免疫检查点抑制剂(ICB)治疗时大量扩增并转变表型,成为向肿瘤浸润的CD8+T细胞主力[1]。脾脏,行!

论文首页截图
免疫治疗都用到2024年了,科学界当然不至于对免疫治疗的起效流程还是两眼一抹黑,但有一个问题确实悬而未决:响应免疫治疗召唤、浸润到肿瘤部位的肿瘤特异性CD8+T细胞,是从全身哪些部位来的呢?至少目前来看,它们肯定不只是肿瘤内的“原住民”,也不会只来自肿瘤引流淋巴结(tdLN)[2],那按解剖部位和生理功能盘一下,很快就轮到脾脏了。
MIT研究者们选用了特异性表达SIY模型抗原的肺癌细胞,向小鼠皮下植入癌细胞、再用ICB进行治疗,以此来追踪肿瘤特异性CD8+T细胞的动态;在ICB有效延缓肿瘤生长的同时,小鼠脾脏内同步发生了极为明显的SIY反应性CD8+T细胞积聚,发生部位属于脾脏白髓(white pulp),白髓也是这些肿瘤反应性CD8+T细胞在ICB治疗后扩增的主要场所。
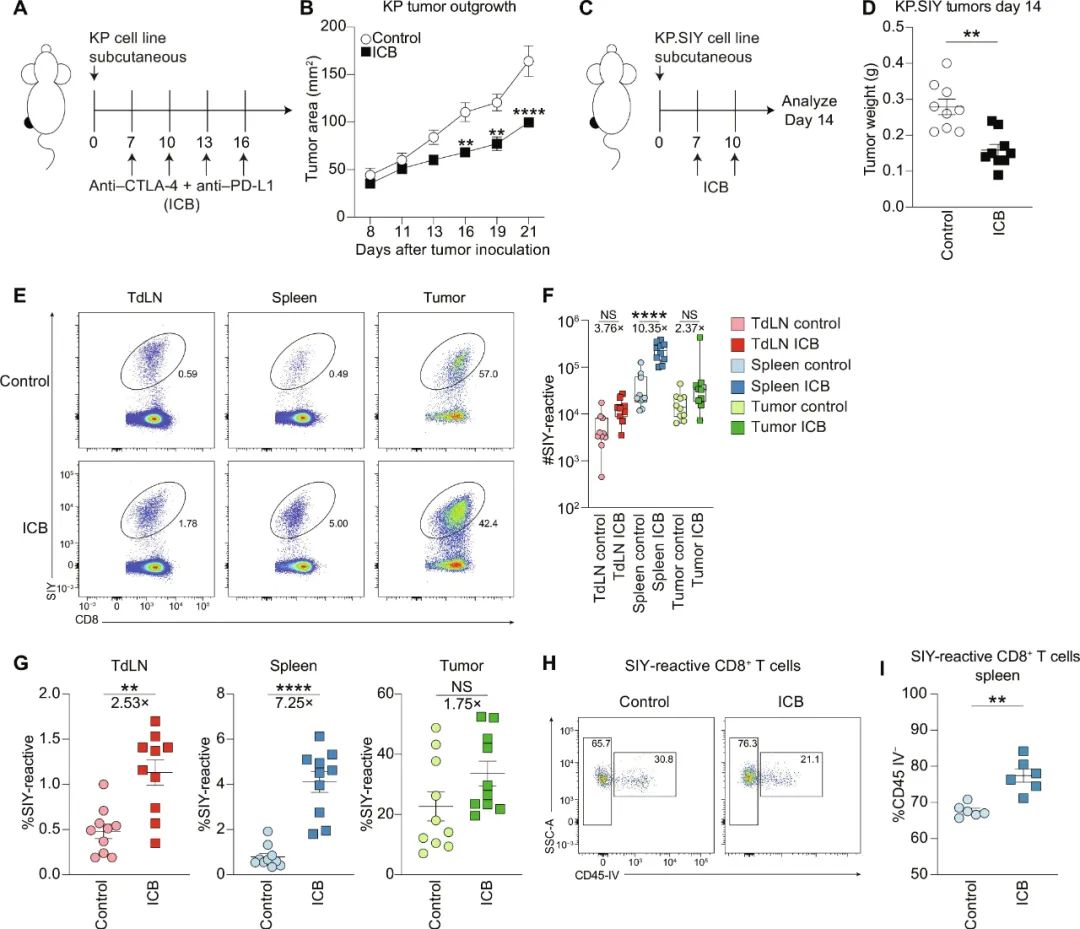
ICB治疗后,肿瘤反应性CD8+T细胞在脾脏白髓内积聚
借助单细胞RNA测序和T细胞受体(TCR)测序,研究者们进一步分析了肿瘤内、tdLN和脾脏白髓的肿瘤反应性CD8+T细胞转录表型,肿瘤内以终末耗竭表型为主、tdLN里更多是前体/祖细胞T细胞都很合理,但白髓中的CD8+T细胞则独自处在耗竭中期状态,它们和tdLN中的同类是ICB治疗后,发生数量显著扩增的主要CD8+T细胞群体。
而ICB治疗后CD8+T细胞数量的扩增,还同步伴随着TCR库多样性( TCR repertoire diversity)的下降,说明扩增的只是一小部分具有肿瘤反应性的CD8+T细胞,而它们实际上的源头都是前体T细胞,还得完成前体T细胞→祖细胞T细胞→耗竭中期CD8+T细胞的三步走,并在脾脏完成关键的表型转化(祖细胞T细胞转变为耗竭中期状态、发生扩增的“中间1型”);而调控这一过程的“催化剂”,则是少量被树突状细胞交叉呈递到脾脏的抗原,一点就够。
肿瘤反应性CD8+T细胞们离开脾脏到其它部位,例如tdLN和肿瘤内部后,就各走各的表型转变之路了。而被ICB主要调动起来的,就是在进化曲线上下一步即将走向终末耗竭(“耗竭1型”)的“中间1型”细胞:过继性细胞转移实验再次证实,“中间1型”细胞们首先在脾脏白髓扩增,然后就向tdLN转移并发生致敏(T cell priming),再浸润到肿瘤战场之中。
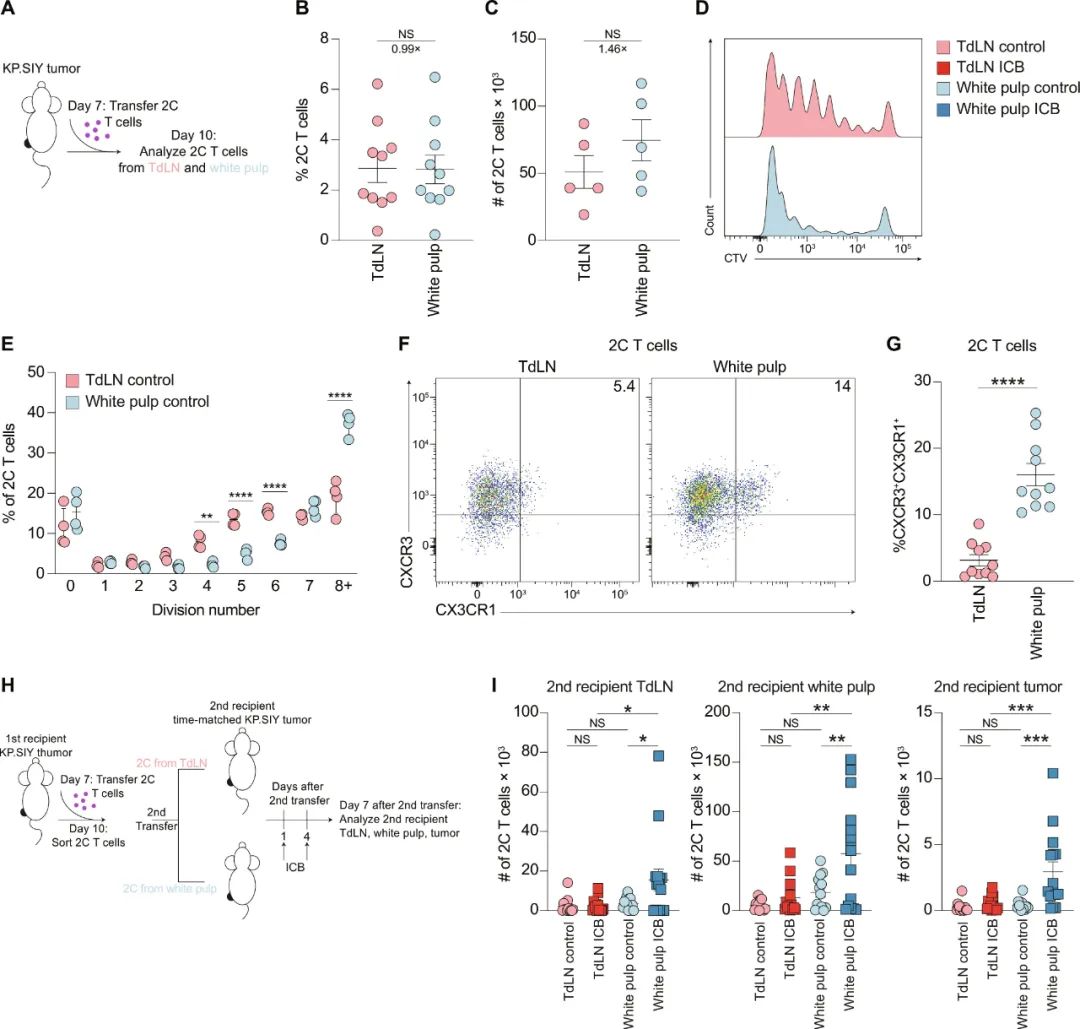
来自脾脏的肿瘤反应性CD8+T细胞是响应ICB治疗的主力
脾脏真不愧是免疫器官、造血器官和储血器官,免疫治疗调动的CD8+T细胞大部队驻扎在这里就很合理,接下来科学家们就可以多想点招,让脾脏里的CD8+T细胞们出动得更多更凶猛,免疫治疗的效果不就上来了嘛。
参考文献:
[1]Morgan D M, Horton B L, Bhandarkar V, et al. Expansion of tumor-reactive CD8+ T cell clonotypes occurs in the spleen in response to immune checkpoint blockade[J]. Science Immunology, 2024, 9(99): eadi3487.
[2]Wu T D, Madireddi S, de Almeida P E, et al. Peripheral T cell expansion predicts tumour infiltration and clinical response[J]. Nature, 2020, 579(7798): 274-278.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


