Biomaterials:通过空间位阻效应调节纳米反应器整合STING激活和COX-2抑制用于癌症化学免疫治疗
来源:生物谷原创 2024-07-31 10:28
本研究提出了一种时间重塑策略,通过开发一种空间位阻效应调谐的锌基金属有机框架(MOF),称为CZFNPs。
纳米材料诱导的细胞毒性治疗后的肿瘤缩小主要源于活性氧(ROS)介导的对快速增殖的癌细胞的细胞毒性损伤。然而,这些直接针对肿瘤细胞的治疗方法在体内环境中未能显示出预期的效率。
本质上,肿瘤微环境(tumor microenvironment, TME)是一个由多种细胞和非细胞成分组成的复杂环境,包括免疫细胞、成纤维细胞、内皮细胞、细胞外基质、细胞因子和生长因子。这些因素动态地相互作用,影响肿瘤的生长、侵袭、转移和对治疗的反应。
因此,仅仅根据癌细胞的特性来了解癌症生物学是不够的。考虑TME,特别是肿瘤免疫微环境(TIME)对采用纳米材料诱导的细胞毒性治疗干预的治疗效果的复杂贡献变得势在必行。然而,包括三阴性乳腺癌在内的众多“冷”肿瘤的时代特点是T细胞浸润不足,免疫抑制细胞浸润升高,免疫原性低,这阻碍了免疫治疗的抗肿瘤效果以及与细胞毒治疗的联合治疗。
至关重要的是,干扰素基因刺激因子(STING)通路在“冷”肿瘤向“热”肿瘤的转化中起着关键作用。具体来说,环GMP-AMP合成酶(cGAS)可以识别并催化细胞质中损伤相关双链DNA (dsDNA)生成环[G (2 ',5 ')pA (3 ',5 ')p] (cGAMP),作为激活STING和诱导I型干扰素(ifn)的第二信使。
在多种金属离子中,锌离子(Zn2+)不仅能促进cGAS蛋白的相分离,还能增强cGAS的酶催化活性。Zn2+还可以导致细胞内内源性活性氧(ROS)的积累。除了引起化疗的细胞毒性损伤外,过量的细胞内ROS可导致线粒体损伤和线粒体DNA (dsDNA的一种)的释放,从而触发cGAS-STING途径介导的先天免疫反应。然而,细胞毒性治疗引发的环氧化酶(COX)-2表达增强会导致肿瘤细胞产生治疗耐药和抗肿瘤免疫耐受。

图片来源:https://doi.org/10.1016/j.biomaterials.2024.122695
近日,来自青岛大学附属医院的研究者们在Biomaterials杂志上发表了题为“Integration of STING activation and COX-2 inhibition via steric-hindrance effect tuned nanoreactors for cancer chemoimmunotherapy” 的文章,该研究揭示了通过空间位阻效应调节纳米反应器整合STING激活和COX-2抑制用于癌症化学免疫治疗。
将免疫治疗与基于纳米材料的化疗相结合,是提高抗肿瘤效果的一个有希望的途径。然而,化疗诱导的肿瘤免疫微环境(TIME)的抑制性和环氧化酶-2 (COX-2)的上调会阻碍化疗免疫治疗的效果。
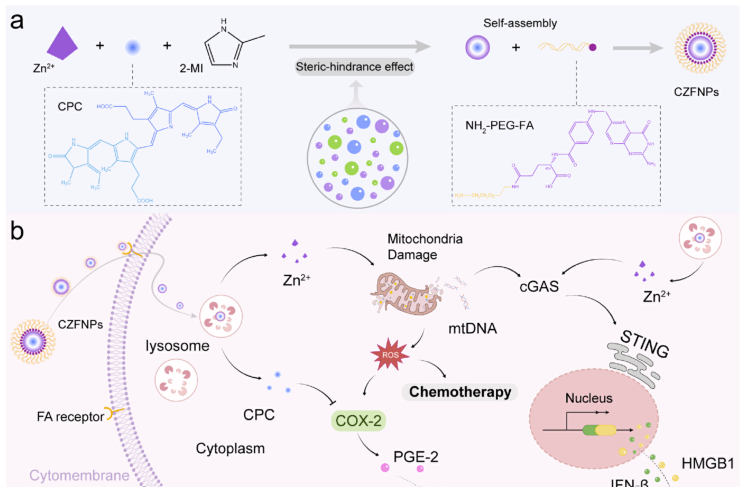
利用STING和COX-2信号的位阻效应调谐纳米反应器用于癌症化学免疫治疗
图片来源:https://doi.org/10.1016/j.biomaterials.2024.122695
本研究提出了一种时间重塑策略,通过开发一种空间位阻效应调谐的锌基金属有机框架(MOF),称为CZFNPs。该纳米反应器是通过将COX-2抑制剂c -藻蓝蛋白(CPC)原位加载到框架构建块中来设计的,同时削弱了MOF的稳定性。因此,CZFNPs在特异性运输到过表达叶酸受体的肿瘤细胞时,实现了锌离子(Zn2+)和CPC的快速ph响应释放。因此,Zn2+可以诱导活性氧(ROS)介导的细胞毒性治疗,同时与线粒体DNA (mtDNA)释放同步,从而刺激mtDNA/cGAS-STING途径介导的先天免疫。
CPC抑制化疗诱导的COX-2过表达,从而协同重编程抑制时间,增强抗肿瘤免疫反应。在异种移植肿瘤模型中,CZFNPs系统有效地调节STING和COX-2的表达,将“冷”肿瘤转化为“热”肿瘤,从而使肿瘤的消退率比单独使用ZIF-8治疗高约4倍。这种方法为提高基于纳米材料的化疗和免疫治疗的联合疗效提供了一种有效的策略。
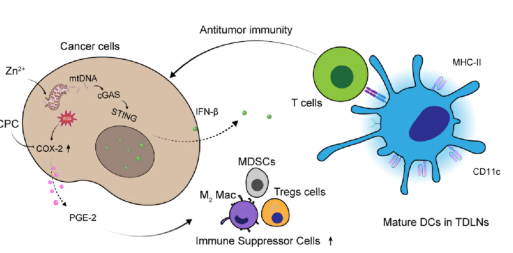
局部瘤内给予zn2+和CPC抑制异种移植物肿瘤
图片来源:https://doi.org/10.1016/j.biomaterials.2024.122695
综上所述,本研究的潜在治疗价值在于将COX-2抑制剂CPC作为免疫佐剂整合到锌MOF中,以提高化疗免疫治疗乳腺肿瘤的疗效。空间位阻效应调节的框架单元实现了CPC的包封,锌MOF在不同pH水平下的稳定性调控。
该纳米反应器利用细胞内氧化应激,伴随着ros介导的细胞毒性和线粒体损伤,从而激活mtDNA刺激cGAS/STING通路,增加DCs的成熟和T细胞浸润。酸性TME中释放的CPC不仅发挥了PAI的优势,还下调了COX-2,对免疫抑制的TME进行了重编程,进一步增强了抗肿瘤免疫应答。
体内实验证实,czfnps介导的联合治疗通过刺激mtDNA/cGAS-STING途径介导的先天免疫,下调免疫抑制细胞,有效逆转肿瘤免疫抑制。因此,这项工作为细胞毒性治疗和免疫治疗的结合开辟了一个有希望的方向,对改变肿瘤治疗策略具有潜在的意义。(生物谷Bioon.Com)
参考文献:
Pengfei Zhang et al. Integration of STING activation and COX-2 inhibition via steric-hindrance effect tuned nanoreactors for cancer chemoimmunotherapy. Biomaterials. 2024 Jun 29:311:122695. doi: 10.1016/j.biomaterials.2024.122695.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


