给肝癌患者试药,究竟应该用哪种模型?约翰霍普金斯团队的这个研究说清楚了!
来源:奇点糕 2022-10-06 08:43
在全球范围内,肝细胞癌(HCC)是导致癌症相关死亡的第四大癌症。HCC的晚期治疗手段在2017年以前,一直局限于抗血管生成的酪氨酸激酶抑制剂的使用。
在全球范围内,肝细胞癌(HCC)是导致癌症相关死亡的第四大癌症。HCC的晚期治疗手段在2017年以前,一直局限于抗血管生成的酪氨酸激酶抑制剂的使用。
随着2017-2018年纳武利尤单抗和帕博利珠单抗被美国食品药品管理局批准用于晚期HCC的二线治疗,免疫疗法,特别是免疫检查点抑制剂疗法(ICT),极大地改变了晚期HCC的治疗方式[1]。
然而,大部分HCC患者并不能从ICT疗法中获益。因此,越来越多的研究选择利用同系肿瘤小鼠模型来研究ICT在HCC治疗中失效的机制,以及帮助患者测试新的组合疗法。
随之而来的问题是,HCC的同系肿瘤小鼠模型有很多选择,哪一个模型最合适呢?
近日,由约翰霍普金斯大学医学院Won Jin Ho和Mark Yarchoan领导的课题组,在著名期刊Hepatology上发表一项重要研究成果[2],回答了上述问题。
研究人员通过质谱流式技术(CyTOF)等多种方法,分析并比较了四种最常用的HCC同系肿瘤小鼠模型(Hepa53.4,Hepa 1-6,RIL-175和TIBX)的免疫微环境。他们发现,这四种模型的免疫微环境不尽相同,其基线状态下存在着多种免疫抑制通路。此外,研究人员还发现,Hepa53.4,RIL-175和TIBX三种模型的免疫微环境代表了绝大多数HCC患者的免疫微环境。
该研究为科研工作者在探索HCC的免疫治疗手段的过程中如何选择合适的同系肿瘤小鼠模型提供了重要指导。

论文首页截图
接下来我们就一起来看看这个研究是如何展开的。
研究人员首先利用成像质谱流式技术(Imaging CyTOF),对四种最常用的原位HCC同系肿瘤小鼠模型的免疫微环境进行了分析。
用于这四种模型的细胞系包括:(1)来源于C57L/J品系小鼠自发HCC的细胞系Hepa 1-6;(2)来源于C57BL/6J品系小鼠致癌物诱导的HCC的细胞系Hep53.4;(3)来源于C57BL/6J品系小鼠带有P53和HRas蛋白突变的细胞系RIL-175;(4)来源于BALB/c品系小鼠的细胞系TIBX。
成像质谱流式技术(Imaging CyTOF)结果显示,Hepa 1-6模型中,CD4+,CD8+和FoxP3+T细胞以及巨噬细胞的浸润程度较高。同时,Hepa 1-6模型中也发现有与HCC患者预后相关的三级淋巴结构。
Hep53.4模型也有较高的细胞毒性T细胞(Tc),辅助性T细胞(Th)和树突状细胞浸润,但是巨噬细胞浸润度较低。RIL-175和TIBX模型的巨噬细胞浸润较多,但Tc和Th细胞浸润较少。
通过对各细胞类群之间距离的可视化分析,研究人员还发现,相较于RIL-175和TIBX模型,Hepa 1-6和Hep53.4模型的效应T细胞和抗原呈递细胞之间存在着更丰富的相互作用。这些相互作用可能意味着Hepa 1-6和Hep53.4肿瘤细胞可以被免疫系统更好的识别。
此外,相较于其他三种模型,TIBX模型中,T细胞与M2型巨噬细胞距离更近。结合TIBx模型中存在着的丰富的巨噬细胞,这可能意味着TIBX模型具有更抑制性的免疫微环境。
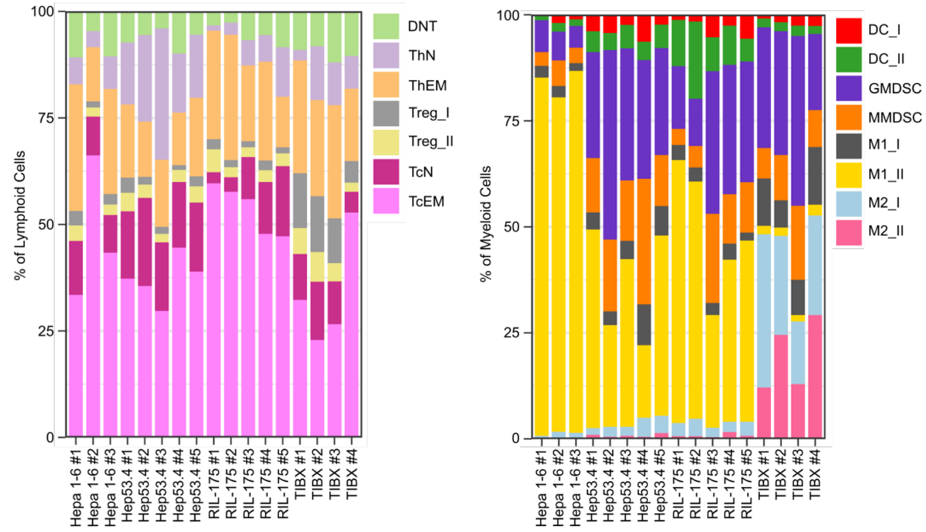
质谱流式结果显示不同HCC同系肿瘤小鼠模型具有独特的免疫微环境
考虑到基于肿瘤切片的成像质谱流式技术可能存在取样偏差,研究人员又用质谱流式技术对肿瘤总体微环境进行了分析。
结果显示,Hepa 1-6和TIBx模型分别具有最高和最低比例的CD8+T细胞;Hepa 1-6模型中M1型巨噬细胞较多,而抑制性的M2型巨噬细胞以及髓源性抑制细胞较少;TIBX模型中髓系细胞的分布与Hepa 1-6模型正好相反。这些结果与成像质谱流式技术的发现一致。
为了了解不同模型中肿瘤免疫微环境的差别是否会导致肿瘤对PD-1抑制剂的不同响应效果,研究人员对接受安慰剂或者PD-1抑制剂的原位HCC小鼠模型进行了生存分析。
结果显示,TIBx模型对PD-1抑制剂没有响应。在Hep53.4和RIL-175模型中,PD-1抑制剂能一定程度上抑制肿瘤发展速度,延长小鼠生存期。这些结果在皮下HCC模型中也得到了验证。鉴于成像质谱流式结果显示Hep53.4模型中Tc浸润程度较高,研究人员猜测,PD-1抑制剂对Hep53.4肿瘤的抑制效果可能来源于这些Tc细胞。研究人员在Hep53.4模型中使用抗体清除CD8+T细胞后,发现PD-1抑制剂带来的生存优势消失,证明PD-1抑制剂的效果的确依赖于这些CD8+T细胞。
需要指出的是,Hepa 1-6模型结果比较特殊。首先,Hepa 1-6肿瘤发展显著慢于其他模型。其次,在Hepa 1-6原位HCC模型中,接受安慰剂治疗的小鼠与接受PD-1抑制剂治疗的小鼠的生存期并无明显区别。
研究人员认为,导致这些结果的原因可能是Hepa 1-6肿瘤细胞和接受肿瘤移植的C57BL/6小鼠的主要组织相容性复合体不匹配(Hepa 1-6细胞中是H2bc,而C57BL/6小鼠中是H2b)。
总体而言,不同模型肿瘤对PD-1抑制剂的响应效果与其独特的免疫微环境相符。
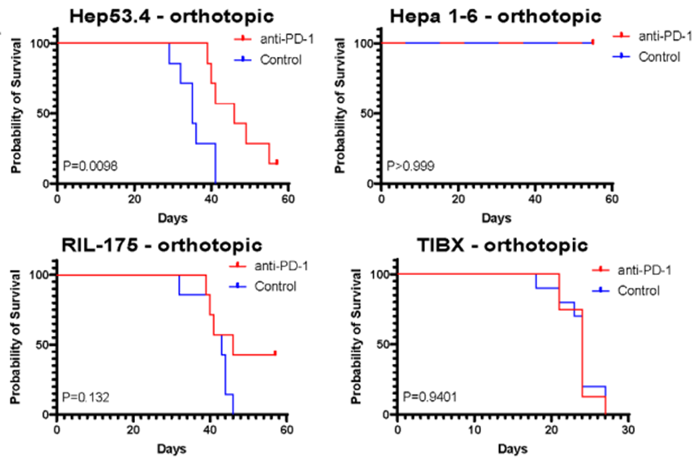
不同模型对PD-1抑制剂响应不同
最后,为了弄清楚这些小鼠模型的免疫微环境是否能反映HCC患者的免疫微环境,研究人员利用算法(CIBERSORT)对癌症基因组图谱(TCGA)中HCC患者中各免疫细胞类群的丰度进行了评估,并将之与上述四种小鼠模型的免疫微环境进行了比较。
结果发现,大约各有30%的HCC患者的免疫微环境和Hep53.4,RIL-175以及TIBX模型相似。其中,TIBX模型中的免疫微环境与病毒引起的HCC的患者的免疫微环境较为相似。
仅有0.04%的HCC患者具有和Hepa 1-6模型类似的免疫微环境。基于这一结果,以及之前提到的Hepa 1-6模型中主要组织相容性复合体不匹配的问题,研究人员认为使用Hepa 1-6模型来研究免疫疗法可能会产生误导性的结论。
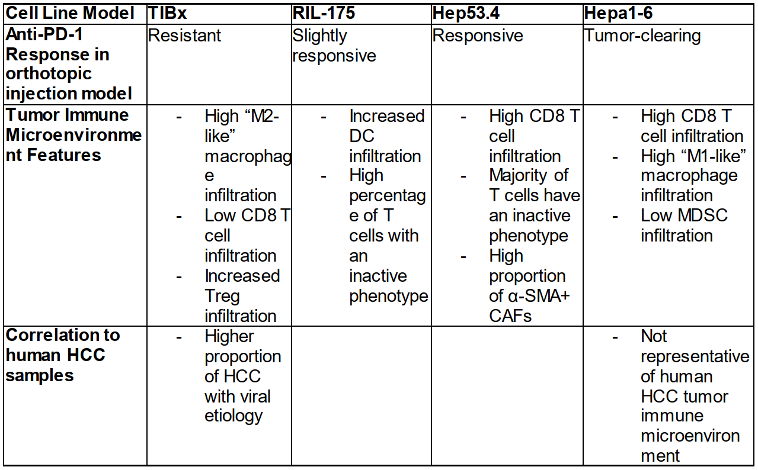
四种HCC同系肿瘤小鼠模型中的主要发现
总的来说,该研究揭示了不同HCC同系肿瘤小鼠模型免疫微环境的差异,为研究人员如何选择合适的HCC模型提供了指导。
比如,鉴于TIBX模型中M2型巨噬细胞浸润程度较高这一特点,利用该模型来研究靶向M2巨噬细胞的免疫疗法(单独或者与PD-1抑制剂联合使用)可能会事半功倍。
同时,不同模型独特的免疫微环境会导致对同一种免疫疗法产生不同效果。鉴于HCC患者异质性的存在,因此,要提高研究成果的可靠性以及可转化性,科研人员应当考虑在研究中使用多种HCC动物模型,包括该研究未涉及的转基因小鼠模型,人源化小鼠模型等。
参考文献:
[1] Luo XY, Wu KM, He XX. Advances in drug development for hepatocellular carcinoma: clinical trials and potential therapeutic targets. J Exp Clin Cancer Res. 2021;40(1):172. Published 2021 May 18. doi:10.1186/s13046-021-01968-w
[2] Zabransky DJ, Danilova L, Leatherman JM, et al. Profiling of murine syngeneic HCC tumor models as a framework to understand anti-PD-1 sensitive tumor microenvironments. Hepatology. 2022;10.1002/hep.32707. doi:10.1002/hep.32707
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


