《细胞》:肿瘤竟能“挤碎”T细胞!中国科学家发现全新免疫检查点,可让T细胞在肿瘤高硬度挤压下功能耗竭
来源:奇点糕 2024-05-18 12:03
新研究表明,Osr2有望成为针对实体瘤中CAR-T细胞功能衰竭的新干预靶点,这为提升固体肿瘤免疫治疗效果开启了新的可能。
近日,厦门大学的周大旺与陈兰芬教授联合陆军军医大学的叶丽林教授团队破解了肿瘤“压垮”T细胞的机制。论文于近日发表在《细胞》期刊上。
真是物理意义上的压垮!
他们发现,肿瘤组织中硬度较高的高度纤维化区域,可以通过机械应力诱导抗肿瘤T细胞功能耗竭。T细胞表面的机械敏感性通道蛋白能够将这种外来的机械应力转变为细胞内生化信号,与T细胞表面受体(TCR)信号协同诱导转录因子Osr2的表达,重塑T细胞表型,促进功能耗竭。
这项研究鉴定Osr2为CD8阳性T细胞在响应机械应力时的一个关键免疫检查点。小鼠实验中,敲除Osr2可以大大缓解CAR-T疗法应用于实体瘤治疗时的T细胞耗竭问题,提高疗效。

论文首页截图
在发生和进展过程中,肿瘤不仅会改变生物学行为,还会改变物理特性。
论单个肿瘤细胞,通常是要比非恶性肿瘤细胞更软。2021年发表在Nature Biomedical Engineering的一篇论文已经揭露肿瘤细胞“以柔克刚”的手段,将细胞硬度减低鉴定为一种物理免疫检查点,证明通过消耗肿瘤细胞质膜胆固醇使硬度增加,能够削弱其对T细胞杀伤作用的抵抗。
细胞外基质(ECM)呢,其结构改变和硬度增强是癌症的典型标志。这些变化主要由肿瘤相关成纤维细胞(CAFs)引起,与细胞外基质蛋白的异常产生和交联相关,导致实体瘤组织通常比正常组织更为坚硬。这种“地形”变化对T细胞的作战行动造成了影响,降低ECM硬度可以改善T细胞迁移和提高癌症免疫检查点阻断(ICB)疗效,而这方面的机制尚不明了。
此次,研究团队试图探索和理解ECM硬度变化对CD8+T细胞的具体影响和潜在机制。
研究团队利用肝细胞癌患者的样本观察到,肿瘤组织的高纤维化区域富集着处于耗竭状态的CD8+T细胞(TEX)。在构建体外模型,使用不同硬度的聚二甲基硅氧烷(PDMS)凝胶模拟肿瘤微环境时,他们发现ECM硬度提高会显著促进和增强活化T细胞的耗竭,表现为IFN-γ和TNF-α的低表达及PD-1和TIM-3的高表达。
这意味着,肿瘤可能借以坚硬的ECM,给T细胞施加着真正物理意义上的巨大压力。(真·压力大到歇菜)
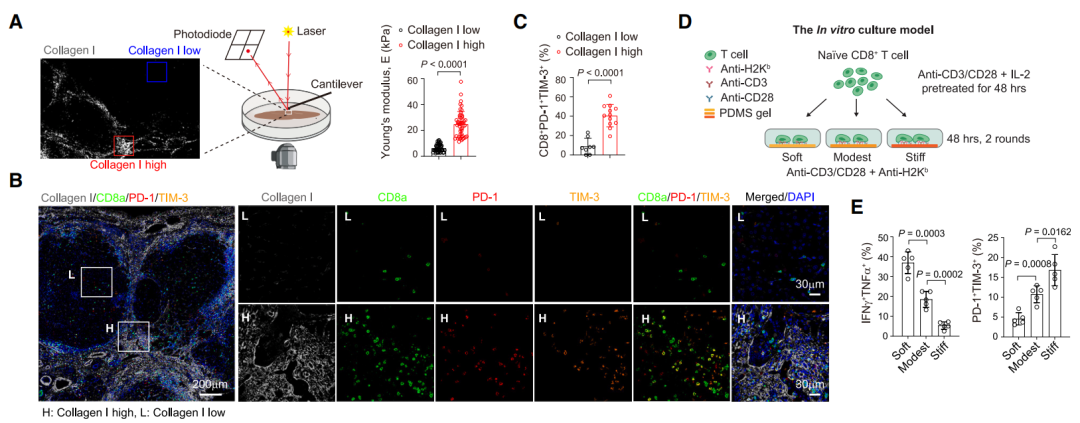
患者肝癌组织样本和体外实验模型结果显示,ECM硬度与T细胞耗竭有关
要想帮助T细胞解困,我们得先找到T细胞身上的“受力点”,也就是负责感受机械刺激并将其转化为细胞内生化信号的机械敏感性离子通道 (MSIC)。
经过体外实验和小鼠实验验证,研究团队将目光锁定在机械敏感性离子通道蛋白Piezo1上。他们发现,Piezo1在活化CD8+T细胞表面高度表达,Piezo1感受到外界的机械应力后激活,结构改变、通道开放,促进钙离子内流,导致了CD8+T细胞的耗竭程度。
使用Piezo1抑制剂或者基因敲除手段,可以减轻CD8+T细胞在硬化培养基质或肿瘤中的耗竭情况,表现出更强的细胞毒性和增殖能力;相反,Piezo1激活剂处理会抑制CD8+T细胞的增殖和产生IFN-γ。
接下来的研究,揭示了肿瘤组织如何使用物理攻击压垮T细胞。
从机制上来看,当T细胞遇到高硬度的ECM时,Piezo1作为机械敏感性离子通道将机械应力转化为钙信号,激活T细胞内CREB等转录因子,进而促进转录因子Osr2表达。Osr2的上调能够重塑T细胞的表观遗传状态,抑制T细胞杀伤功能的基因表达,从而引起和加剧T细胞的耗竭状态。此外,Osr2的表达不仅依赖于机械应力,还需要通过T细胞受体(TCR)的信号共同诱导。
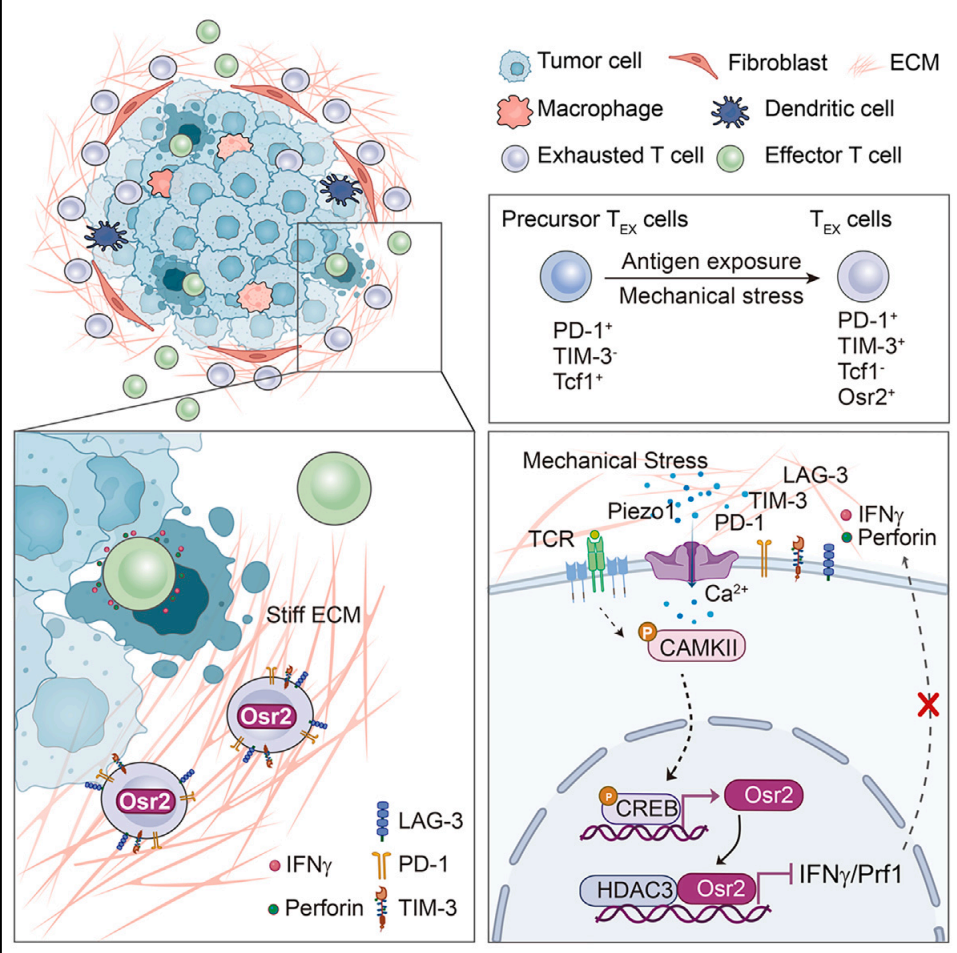
机制
正巧,CAR-T细胞疗法在实体瘤中面临的一大挑战,便是无法避免的T细胞功能衰竭。利用结直肠癌小鼠模型,研究团队探索敲除Osr2的基因是否能够提升CAR-T细胞疗法在实体瘤治疗中的效果。
结果显示,相较于Osr2正常表达的CAR-T细胞,敲除Osr2的CAR-T细胞在输注回小鼠体内后,对肿瘤生长的控制明显增强。T细胞增殖数量增加、凋亡数量减少,表达细胞毒性因子的效应T细胞占比增多,PD-1、TIM-3和LAG-3等耗竭相关标志物表达降低。
也就是说,Osr2有望成为针对实体瘤中CAR-T细胞功能衰竭的新干预靶点,这为提升固体肿瘤免疫治疗效果开启了新的可能。
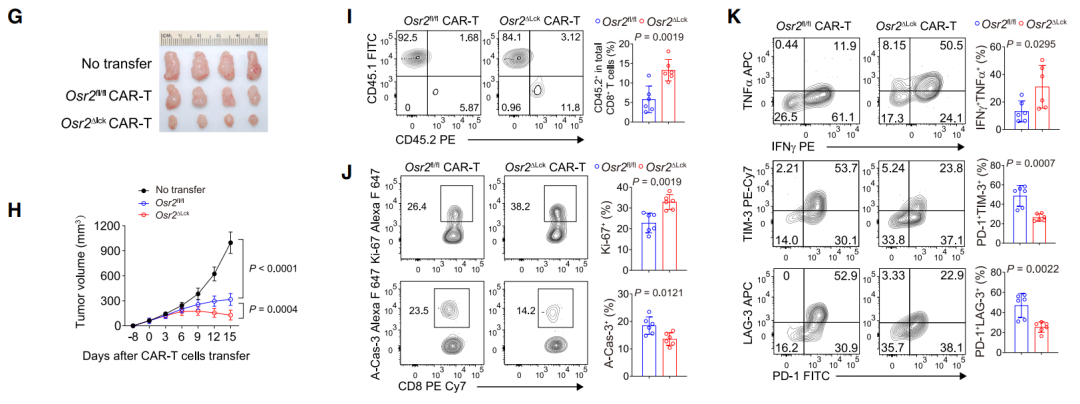
敲除Osr2可以缓解CAR-T疗法中的T细胞耗竭问题
这项研究拓展了我们对肿瘤利用其物理特性进行免疫逃逸的理解,又找到了一种帮助抗肿瘤T细胞排忧解难的方式。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


