温医大沈贤团队开发铜死亡纳米系统,增强癌症免疫治疗
来源:生物世界 2024-03-07 14:55
该研究的结果可以为铜死亡介导的抗肿瘤治疗提供一种新策略,还能够增强免疫检查点抑制剂的治疗效果。
2012年5月,哥伦比亚大学 Brent Stockwell 教授在 Cell 期刊发表论文【1】,发现并提出了一种铁依赖性的新型细胞程序性死亡方式——铁死亡(Ferroptosis)。
和铁一样,铜也是从细菌和真菌到植物、动物以及人类生命活动的基本元素,作为必须酶的辅助因子,在生命活动中发挥着必不可少的作用。铜在人体中是一种微量元素,细胞内铜离子的浓度通过主动稳态机制保持在非常低的水平,一旦超过阈值,铜就会变得有毒,导致细胞死亡。
2022年3月,哈佛-MIT博德研究所 Todd Golub 教授在 Science 期刊发表论文【2】。发现并证实铜依赖性受控细胞死亡方式是一种不同于已知细胞死亡机制的新型细胞死亡方式——铜死亡(Cuprotosis)。
作为一种新型受控细胞死亡方式,诱导肿瘤细胞铜死亡已成为一种有前景的肿瘤治疗策略。
近日,温州医科大学附属第二医院/育英儿童医院沈贤、孙维建、俞耀军等人在 Advanced Science 期刊发表了题为:Elesclomol Loaded Copper Oxide Nanoplatform Triggers Cuproptosis to Enhance Antitumor Immunotherapy 的研究论文【3】。
该研究通过将氧化铜(CuO)纳米颗粒与铜离子载体(Elessclomol,ES)封装在聚乙二醇聚合物(PEG)中,构建了一种诱导铜死亡的纳米系统——ES@CuO。ES@CuO被肿瘤细胞摄取后,降解释放Cu2+和ES,协同触发铜死亡,显著抑制小鼠黑色素瘤生长。ES@CuO还进一步促进了铜死亡介导的免疫反应,并通过增加肿瘤浸润淋巴细胞的数量和分泌炎性细胞因子来重编程免疫抑制性肿瘤微环境。此外,将ES@CuO与PD-1免疫治疗相结合,显著提高了对小鼠黑色素瘤的抗肿瘤效果。
总的来说,该研究的结果可以为铜死亡介导的抗肿瘤治疗提供一种新策略,还能够增强免疫检查点抑制剂的治疗效果。

黑色素瘤是最致命的皮肤癌类型,起源于黑素细胞的恶性转化。黑色素瘤是全球第五大常见癌症,也是皮肤癌相关死亡的主要原因。该疾病经常转移,并可以通过淋巴结和血管扩散到远处器官(例如大脑、肺、肝和骨骼)。目前,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂(ICI)在临床上对黑色素瘤患者表现出良好的治疗效果。
尽管肿瘤免疫疗法能够显著增强治疗效果,但由于免疫抑制性肿瘤微环境(TME)和抑制抗肿瘤免疫,目前基于PD-1/PD-L1的免疫疗法受到低响应率的限制。随着黑色素瘤发病率的不断增加,迫切需要提高免疫疗法效果并开发替代治疗方法,以改善患者的生存。
铜死亡由细胞内铜离子(Cu2+)的积累引发,随后与线粒体三羧酸循环(TCA)中的脂酰化组分结合,导致脂酰化蛋白质聚集和随后的铁硫簇蛋白下调,从而导致蛋白质毒性应激并最终导致细胞死亡。
铜死亡是一种铜依赖性免疫原性细胞死亡(ICD)形式,涉及通过释放许多损伤相关分子模式(DAMP)和肿瘤相关抗原的免疫反应。因此,铜死亡可以逆转免疫抑制性肿瘤微环境,并进一步增强基于免疫检查点抑制剂(ICI)的免疫治疗的疗效。
然而,铜死亡强烈依赖于线粒体内Cu2+的持续积累,而肿瘤细胞内Cu2+受到谷胱甘肽、Cu2+转运蛋白和代谢蛋白的强烈限制,这是有效诱导铜死亡的主要障碍。因此,进一步提高肿瘤细胞内Cu2+的积累对于基于铜死亡的抗肿瘤治疗非常有意义。
作为具有优异特性的金属氧化物纳米颗粒,氧化铜纳米颗粒(CuO NP)因其较高的毒性、高载药潜力和生物相容性,已被用于抗肿瘤和抗微生物治疗的优秀药物递送平台。此外,CuO NP通过内吞作用成功进入细胞,并在溶酶体的酸性环境中释放Cu2+,最终导致细胞毒性。因此,CuO NP是可能有效引发铜死亡的铜基纳米载体的候选者。
在这项研究中,研究团队将铜离子载体伊利司莫(Elessclomol,简称ES)和氧化铜纳米颗粒(CuO NP)封装在聚乙二醇聚合物(PEG)中,构建了一种诱导铜死亡的纳米系统——ES@CuO。
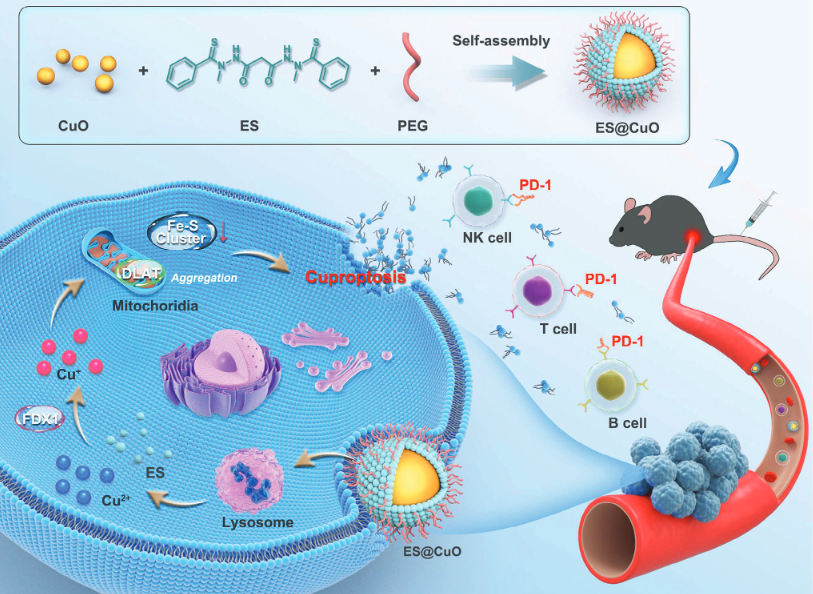
在被肿瘤细胞摄取后,ES@CuO可以在酸性环境中降解,同时释放Cu2+和ES。随后,释放的Cu2+和ES直接靶向运输到线粒体,引起二氢脂酰转移乙酰化酶(DLAT)聚集,导致B16肿瘤细胞的铜死亡。值得注意的是,铜死亡会导致细胞膜损伤,释放大量损伤相关分子模式(DAMP)并有效诱导免疫反应,进一步促进淋巴细胞浸润和炎性细胞因子的分泌,并重编码肿瘤组织中的免疫抑制性肿瘤微环境,从而抑制B16荷瘤小鼠的肿瘤生长。
此外,将ES@CuO与抗PD-1单抗治疗相结合,可显著提高免疫检查点抑制剂(ICI)免疫治疗的抗肿瘤效果。因此,ES@CuO可能是一种有前途的纳米药物,用于诱导基于铜死亡的免疫治疗。
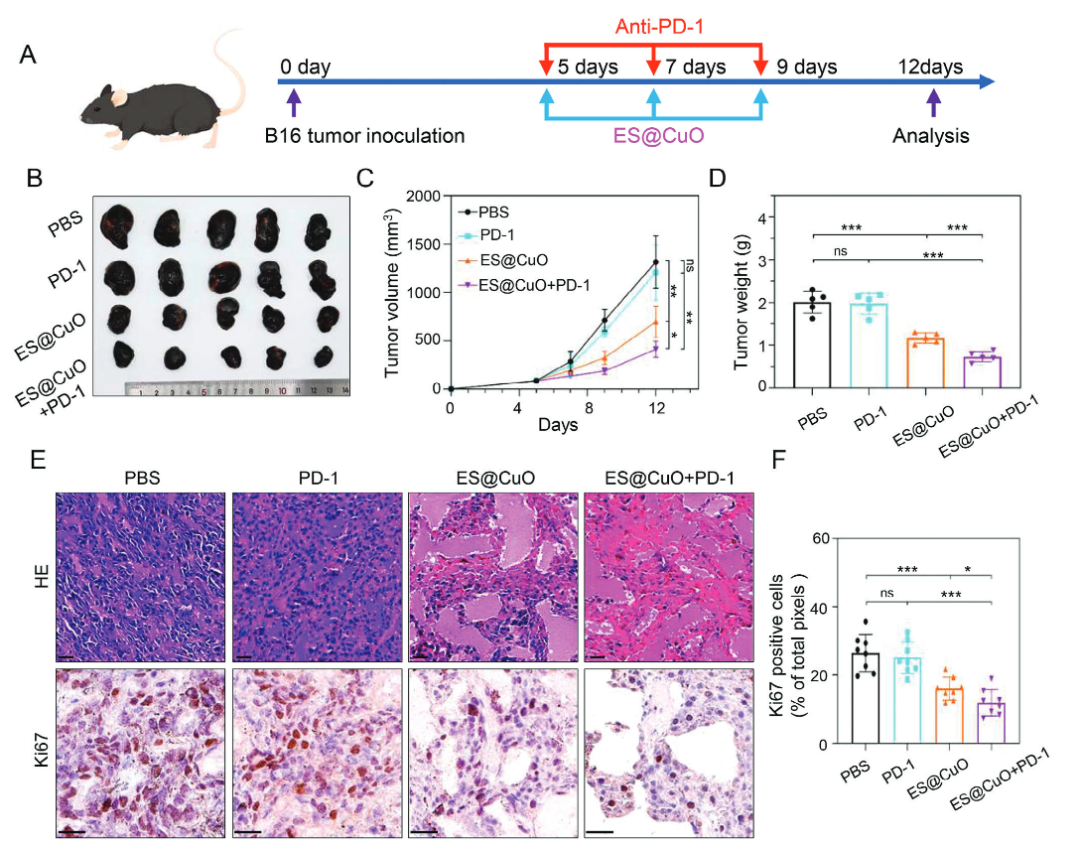
总的来说,该研究的结果可以为铜死亡介导的抗肿瘤治疗提供一种新策略,还能够增强免疫检查点抑制剂的治疗效果。
论文链接:
1. https://doi.org/10.1016/j.cell.2012.03.042
2. https://www.science.org/doi/10.1126/science.abf0529
3. https://doi.org/10.1002/advs.202309984
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


